微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 一定温度下,在密闭容器中,发生反应: 2NO2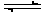 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度? ;
(2)此时NO2的转化率? 。
2、填空题 现有如图所示的转化关系,图中各物质均为常见物质,转化中有部分物质已省略。
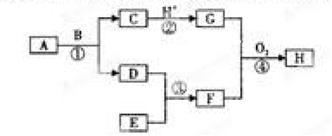
上述物质中C是一种黑色磁性固体,F是极易溶于水且水溶液呈碱性的气体,H是红褐色沉淀,A、D、E均为单质,请回答下列问题:
(1)写出下列物质的化学式:A: 、E
(2)写出④中生成H的非氧化还原反应的离子方程式:
(3)在120℃、1大气压下将168gA和90gB放入1L,密封烧瓶中发生反应①,经过10min达到平衡,平衡后D的质量为4g(固体体积忽略不计),则用D表示10min内的平均反应速率为 ,该温度下此反应的平衡常数K= ,B的转化率是 。
3、选择题 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强/kPa
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度/10-3mol/L
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
4、选择题 实验证明:若用电解熔融KCl制钾,发现钾熔于熔融KCl中难分离,且电解过程中容易发生爆炸事故等。因而工业不用电解熔融KCl制钾,而用金属钠与KCl共熔置换制钾:
Na(l)+KCl(l) NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点: NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点:
| K
| Na
| KCl
| NaCl
| 熔点/℃
| 63.6
| 97.8
| 770
| 801
| 沸点/℃
| 774
| 882.9
| 1500
| 1413
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.低于770℃ B.约850℃ C.高于882.9℃ D.1413~1500℃
5、选择题 在一定温度下,向a L密闭容器中加入1 mol X和2mol Y,发生如下反应:X(s) + 2Y(g)
 2Z(g) ,此反应达到平衡的标志是 2Z(g) ,此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内X、Y、Z的浓度之比为l : 2 : 2
C.容器内各物质的浓度不随时间变化
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
|
|