微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 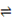 ?CO(g) + 3H2(g)??? ΔH =" +206.2" kJ/mol
?CO(g) + 3H2(g)??? ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g) 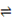 ?CO2(g) +4H2(g)?? ΔH = +165.0kJ/mol
?CO2(g) +4H2(g)?? ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是????????。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
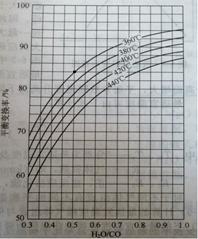
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是?????。
② 汽气比相同时,CO平衡变换率与温度的关系是?????。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp=????????。随温度的降低,该平衡常数??????(填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
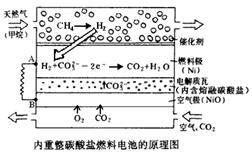
(1)外电路电子流动方向:由??流向???(填字母)。
(2)空气极发生反应的离子方程式是????。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e?转移,有?????g 精铜析出。
参考答案:(12分)
Ⅰ(1)CO(g)+H2O(g)
本题解析:
试题分析:Ⅰ(1)①CH4(g) + H2O(g) 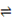 ?CO(g) + 3H2(g)???ΔH1 =" +206.2" kJ/mol
?CO(g) + 3H2(g)???ΔH1 =" +206.2" kJ/mol
②CH4(g) + 2H2O(g)  本题难度:困难
本题难度:困难
2、填空题 (共7分)硫—碘循环分解水制氢主要涉及下列反应:
ⅠSO2+2H2O+I2===H2SO4+2HI
Ⅱ2HI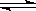 H2+I2
H2+I2
Ⅲ2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
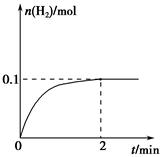
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)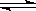 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
参考答案:(1)c (2)0.1 mol·L-1·min-1 64 b
本题解析:
试题分析:(1)因硫酸在常温下稳定,则反应Ⅲ常温下不发生,a错误;由反应Ⅰ可知,还原剂的还原性大于还原产物的还原性,则还原性SO2>HI,即SO2的氧化性比HI的弱,b错误;由反应Ⅰ×2+Ⅱ×2+Ⅲ可得到2H2O
本题难度:一般
3、选择题 下列关于原电池的叙述正确的是 (??? )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
参考答案:B
本题解析:
试题分析:构成原电池的正、负极可以用金属电极与非金属,如碳作电极,原电池中电子流出的一极发生氧化反应,电流的方向是从正极经外电路流向负极,与电子流动的方向是相反的。
本题难度:一般
4、选择题 如图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
A.电池内部含有电解质
B.锌是负极,碳棒是正极
C.电池用完后可埋入土壤
D.锌锰干电池属一次电池
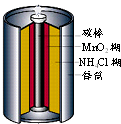
参考答案:A.锌锰干电池中氯化铵是电解质,故A正确;
B.锌锰干
本题解析:
本题难度:一般
5、选择题 银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下:
Ag2O+H2O+2e-=2Ag+2OH-,Zn+2OH--2e-=Zn(OH)2。
下列判断正确的是(? )
A.锌为负极,氧化银为正极
B.锌为正极,氧化银为负极
C.原电池工作时,负极区溶液pH增大
D.原电池反应的化学方程式为Zn+Ag2O+H2O=Zn(OH)2+2Ag
参考答案:AD
本题解析:从电极反应式看,锌失电子被氧化,所以锌为负极;Ag2O得电子被还原,所以是正极。由电极反应式相加可得,总化学方程式:Zn+Ag2O+H2O=Zn(OH)2+2Ag。从负极电极反应式分析,OH-被消耗,所以负极区溶液的pH应减小,选A、D。
本题难度:一般