微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 SO2是大气中常见的污染气体,溶于水后形成的溶液能导电,则SO2属于
A.强电解质
B.弱电解质
C.非电解质
D.不是电解质也不是非电解质
参考答案:C
本题解析:
正确答案:C
SO2+H2O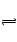 H2SO3
H2SO3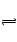 H++HSO3―, SO2溶于水后形成的溶液能导电,是因为与水
H++HSO3―, SO2溶于水后形成的溶液能导电,是因为与水
本题难度:简单
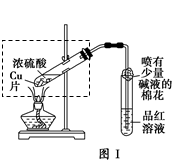
2、实验题 某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。
 ???
???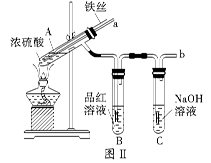
请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
步骤
| 所选试剂
| 现象及结论
|
1
| ?
| ?
|
2
| ?
| ?
|
3
| ?
| ?
?
参考答案:(共12分)
(1)Cu+2H2SO4(浓)
本题解析:
试题分析:
(2)铁丝可进可出,便于控制反应的进行。
(3)铁丝可进出,起到搅拌的作用,玻璃导管没有搅拌作用。A错,选BC。
(4) ①若硫酸过量,得Fe3+;铁过量,得Fe2+;若过量一部分,同时含有Fe2+和Fe3+。
②Fe3+和KSCN溶液反应,溶液变红;Fe2+遇KSCN溶液不变红,加KMnO4溶液后,变红。
本题难度:困难
3、选择题 在自然界中,既有以化合态存在,又有以游离态存在的元素是[???? ]
A.硫
B.硅
C.钠
D.铝
参考答案:A
本题解析:
本题难度:简单
4、实验题 (11分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。用如图所示装置进行Mg和SO2反应的实验。
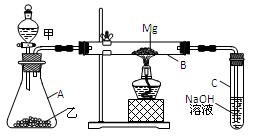
(1)选择制取SO2的合适试剂????????????。
①10%的H2SO4溶液???②80%的H2SO4溶液
③Na2SO3固体????????④CaSO3固体
(2)写出装置乙和B中发生的主要反应的化学方程式:
???????????????????????????????;
???????????????????????????????。
装置C中NaOH溶液的作用是?????????????????????????????。
(3)你认为该装置是否有不足之处??????。如果有,请说明????????????????????。
参考答案:(11分)
(1)②③(2分)?
(2)Na2S
本题解析:略
本题难度:一般
5、实验题 某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
⑴甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到白色沉淀。甲同学为了验证其中白色沉淀的主要成分,设计下列实验。
实验步骤:倾倒掉上层液体后,向所得白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:白色物质溶解,溶液变为蓝色。
实验结论:所得白色固体的化学式为??????????????????。
(2)乙同学与甲同学做相同的实验,还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失,同时产生能使品红溶液褪色的气体,淡黄色固体消失的原因是(用化学反应方程式回答)???????????????????????????????????????????????????。直到最后反应完毕,发现试管中还有铜片剩余。
方法二
(3)丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O。 2CuO,CuO+H2SO4=CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是①_________________________,②_?????????????????????。
方法三
⑷丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色,写出反应的化学反应方程式????????????????????。
参考答案:(9分)[(1)CuSO4??????(1分)?(2)S+2
本题解析:
试题分析:(1)白色的固体中加入适量蒸馏水,白色固体溶解,且观察到溶液为蓝色,这说明所得白色固体为CuSO4。
(2)试管内壁上部析出少量淡黄色固体物质,由存在的元素可知淡黄色固体物质为S,S具有还原性,浓硫酸具有强氧化性,S与浓硫酸发生氧化还原反应,方程式为S+2H2SO4(浓)  3SO2↑+2 3SO2↑+2
本题难度:一般
|