微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中通入适量H2S,产生的沉淀物是
A.FeS和CuS
B.CuS
C.CuS和S
D.Al2S3、FeS和CuS
参考答案:C
本题解析:
试题分析:Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中氧化性离子的强弱顺序为Fe3+>Cu2+>Al3+,其中铁离子氧化H2S生成单质S沉淀,铜离子和硫离子反应生成硫化铜沉淀,铝离子和H2S不反应,有关反应的离子方程式是2Fe3++H2S=S+2H++2Fe2+、Cu2++H2S=CuS↓+2H+,所以最后生成的沉淀为CuS和S,答案选C。2S与硫酸盐反应产物的有关判断
本题难度:一般
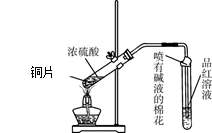
2、实验题 为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。
 ?????
?????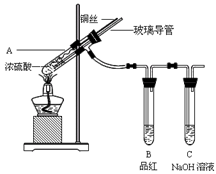
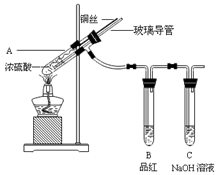 图1??????????????????????????????图2
图1??????????????????????????????图2
(1)比较两实验装置,图2装置的优点是:①???????????;②????????????。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是????。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉
B.氯化钡溶液
C.银粉
D.碳酸氢钠溶液
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是??????????。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有?????的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为???????mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴??????,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为??????mol·L-1。
③甲、乙两方案比较,你认为误差较大的是??????,理由是???????????????????????????。
参考答案:
(1)①能更好地吸收有毒气体SO2,防止其污染环境<
本题解析:
试题分析:
(1)比较两实验装置,图2装置的优点是:①通过铜丝的上下抽动可以使反应随时发生,也可以是反应随时停止,这样就可以控制化学反应的进行;②用品红溶液检验后用NaOH来吸收SO2,可以减少有毒气体的排放,更环保。③由于在图2装置中有一根玻璃导管。当停止加热时,它能平衡压强,这样就可以防止倒吸现象的发生。
(2)①Cu与浓硫酸发生反应:Cu+2H2SO4(浓)  本题难度:困难
本题难度:困难
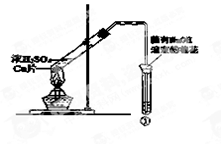
3、选择题 用下图所示装置进行实验,下列对实验现象的解释不合理的是
?
| ①中试剂
| ①中现象
| 解?释
|
A
| Ba(NO3)2溶液
| 生成白色沉淀
| SO32-与Ba2+生成白色BaSO3沉淀
|
B
| 品红溶液
| 溶液褪色
| SO2具有漂白性
|
C
| 紫色石蕊溶液
| 溶液变红
| SO2与水反应生成酸
|
D
| 酸性KMnO4溶液
| 紫色褪去
| SO2具有还原性
?
参考答案:A
本题解析:
试题分析:A、二氧化硫溶于水显酸性,所以通入硝酸钡溶液中被溶液中的H+、NO3-氧化成硫酸根离子,结果生成BaSO4沉淀,错误;B、二氧化硫可以使品红溶液褪色,因为二氧化硫具有漂白性,正确;C、二氧化硫溶于水生成亚硫酸显酸性,使紫色石蕊试液变红色,正确;D、二氧化硫具有还原性可以使酸性高锰酸钾溶液褪色,正确,答案选A。
本题难度:一般
4、选择题 将硫磺在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入Na2S产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素。在下列各组中按A、B、C、D、E排列的是(?? )
A.SO2、H2SO4、H2SO3、H2S、S??????????????????? B.SO2、H2SO3、H2SO4、SO2、SO3
C.SO2、H2SO4、H2SO3、SO2、S??????????????????? D.SO2、H2SO3、H2SO4、H2S、S
参考答案:D
本题解析:硫磺在氧气中燃烧生成气体二氧化硫,所以A为SO2,把气体二氧化硫溶于水得溶液H2SO3,B为H2SO3,向H2SO3中滴加溴水,亚硫酸会生成硫酸,C为硫酸,在硫酸中加入Na2S产生气体硫化氢,D 为硫化氢,将硫化氢通入到亚硫酸中,会得到硫沉淀,所以E为硫。故选D 。
本题难度:简单
5、实验题 (16分)硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是??????????????(填写字母标号)。

(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为?????mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需?????和???????。
(3)用图所示的实验装置验证铜与浓硫酸反应生成的气体产物,则装置②、③分别为???????????。

A.品红溶液? B.BaCl2溶液? C.NaOH溶液? D.AgNO3溶液
(4)装置①中发生反应的化学方程式为?????????????????????????????????????,
若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量?????????????
A.等于6.4克?????? B.大于6.4克 ????? C.小于6.4克 ????? D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为品红溶液, 装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为??????????????????。装置②中的现象是??????????????????。根据装置③观察到有白色沉淀生成的现象 ,?????????(填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
参考答案:(共16分)
(1)C(1分) (2) 1.00(1分
本题解析:
试题分析:(1)浓硫酸具有强氧化性,有很强的腐蚀性。(2)在同一个溶液中的浓度是相等的。配置溶液需要的仪器有,烧杯、玻璃棒、胶头滴管、100mL容量瓶。(3)②中验证SO2用的是品红溶液。③中是进行尾气吸收用的是NaOH溶液。(4)①中发生的是铜和浓硫酸的反应,方程式为:Cu+2H2SO4(浓)="==" CuSO4+SO2↑+2H2O,因为浓硫酸反应过程中浓度越来越稀,到最后呈稀硫酸就不和铜反应了,故产生二氧化硫质量小于6.4克。(5)①中发生的是炭和浓硫酸的反应,方程式为:C+2H2SO4(浓
本题难度:一般
|