微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是?
A.S02和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.Si02是酸性氧化物,能与NaOH溶液反应
C.高温时,CuO比Cu2O稳定
D.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化
参考答案:B
本题解析:
试题分析:A项,S02和Cl2都能使品红溶液褪色,但加热后后者不能恢复原色;B项,正确;C.高温时,CuO可以分解为Cu2O,所以Cu2O比较稳定;D项,只能说明铜在冷的浓硫酸中不发生反应。
点评:S02和Cl2都具有漂白性,但二者漂白原理不同,S02是和有色物质结合生成无色的物质,加热后这种物质会重新分解为有色物质,而Cl2是与有色物质发生氧化还原反应,使有色物质分解为无色物质;
本题难度:简单
2、选择题 NH3和NO在一定条件下,可发生反应:NH3+NO——N2+H2O(未配平),若两物质完全反应,加入的NH3和NO的物质的量之比应为?(???)
A.5∶6
B.4∶5
C.3∶2
D.2∶3
参考答案:D
本题解析:根据升降总数相等可以直接判断二者的比例,不需要将方程式配平。
本题难度:简单
3、填空题 磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为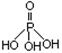 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为???????????。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为???????????。
(2)氧原子核外有?????种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式????????????????????????????????????????????????????????????。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为???????????。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+????→__Ni + ___H2PO3-+ ????。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
参考答案:(1)3S23P3; H<O<P<Na <
本题解析:
试题分析:(1)H原子有1个电子层,O有2个电子层,P和Na有3个电子层且Na质子数少半径大,故半径大小顺序为H<O<P<Na;
(2)氧原子电子排布式为1S22S22P4,同轨道电子能量相同,故3种不同能量的电子;
(3)H2PO2-为弱酸跟离子,在溶液中既能水解又能电离,水溶液呈酸性的原因说明其电离程度大于水解程度,以电离为主;
(4)磷酸分子间脱水应是两个羟基的脱水反应;三聚磷酸钠(俗称“五钠”)即是三聚磷酸中羟基氢被钠取代的产物;
(6)根据氧化还
本题难度:一般
4、填空题 (8分)二氧化硒(Se)是一种氧剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方式???????????????????????????????????????????????。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是??????????????????? ?????。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O
Se+I2+KNO3+H2O
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为?????????。
参考答案: 本题解析:考查氧化还原反应的有关判断和计算等。
本题解析:考查氧化还原反应的有关判断和计算等。
(1)根据已知反应物和生成物并根据电子得失守恒和质量守恒定律可知,反应的化学方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应氧化剂的氧化性大于氧化产物的,所以根据反应的化学方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> SO2。
(3)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的
本题难度:一般
5、实验题 (10分)利用下图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中。请回答:
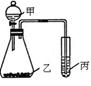
实验试剂
| 实验结论
|
甲
| 乙
| 丙
|
①
| 高锰酸钾
| ②
| 氧化性:KMnO4>Cl2>Br2
 (1)图中①为???????????,②为???????????。 (1)图中①为???????????,②为???????????。
 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表; (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
试剂甲
| 试剂乙
| 试剂丙
| 丙中现象
| 实验结论
| ?
| ?
| ?
| ?
| 酸性:盐酸>碳酸
| ?
| ?
| 石蕊试液
| ?
| ?
?
参考答案:(1)① 浓盐酸?? ②? NaBr或KBr溶液
(
本题解析:
试题分析:(1)由氧化性强的制取氧化性弱的物质,所以①为浓盐酸,②为NaBr或KBr溶液。
(2)要证明酸性的强弱,用强酸制取弱酸。要证明氯水的漂白性,要先制氯气。所以该表为
 试剂甲 试剂甲
试剂乙
试剂丙
丙中现象
实验结论
稀盐酸
大理石
澄清石灰水
本题难度:一般
|
|