微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向恒温、恒容(2 L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:
2SO2(g)+O2(g) 2SO3(g) ΔH=-197.74 kJ·mol-1
2SO3(g) ΔH=-197.74 kJ·mol-1
4 min后达到平衡,这时c(SO2)=0.2 mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是 [???? ]
A.2 min时,c(SO2)=0.6 mol·L-1
B.用O2表示4 min内的反应速率为0.1 mol·(L·min)-1
C.再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1
D.4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小
参考答案:A
本题解析:
本题难度:一般
2、选择题 恒温恒容密闭容器中,进行反应A(s)+2B(g) C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
A.①④
B.②③
C.②③④
D.只有④
参考答案:A
本题解析:
试题分析:由于A是固体,则正反应是气体质量增大的方向,则混合气体密度增大到保持不变时,说明已达平衡,故①正确;正反应是气体物质的量不变的方向,因此无论平衡与否,混合气体的压强或总物质的量均不变,故②③错;正反应是B的物质的量减小的方向,则B的物质的量浓度减小到保持不变时,说明已达平衡,故④正确。
本题难度:简单
3、填空题 反应m A+n B p C在某温度下达到平衡
p C在某温度下达到平衡
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是????????????????????。②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为______态。
参考答案:m+n > P;???????逆反应;???????气
本题解析:
试题分析:①反应m A+n B p C,若A、B、C都是气体,减压后正反应速率小于逆反应速率,这说明减压平衡向逆反应方向移动,即证明逆向反应是气体体积增大的反应,因此m+n>p。
p C,若A、B、C都是气体,减压后正反应速率小于逆反应速率,这说明减压平衡向逆反应方向移动,即证明逆向反应是气体体积增大的反应,因此m+n>p。
②若反应m A+n B p C,C为气体,且m+n=p,在加压时化学平衡发生移动,这说明A、B中至少有一种是固体或纯液体,加压平衡向逆反应方向移动。
p C,C为气体,且m+n=p,在加压时化学平衡发生移动,这说明A、B中至少有一种是固体或纯液体,加压平衡向逆反应方向移动。
③若反应m A+n B p C,如果在体系中增加或减少B的量,平衡均不发生移动,证明B一定是固体或纯液体,不是气体。
p C,如果在体系中增加或减少B的量,平衡均不发生移动,证明B一定是固体或纯液体,不是气体。
本题难度:一般
4、计算题 在2L的密闭容器中,充入1molN2和3molH2,在一定的条件下反应,2分钟后达到平衡状态,相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了1/10,计算:
(1)平衡时混合气体中三种气体的物质的量比为多少?
(2)N2的转化率为多少?
(3)2分钟内,NH3的平均反应速率为多少?
参考答案:(1)2:6:1
(2)20%
(3)0.1m
本题解析:
本题难度:一般
5、计算题 (I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O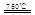 CaO+2HBr????②2HBr+Hg
CaO+2HBr????②2HBr+Hg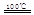 HgBr2+H2
HgBr2+H2
③HgBr2+_____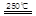 _____ + ?????????④2HgO
_____ + ?????????④2HgO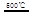 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________?????????_。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________?????????????__。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g)?△H<0
CO2(g)+H2(g)?△H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
参考答案:(16分)??
(I)HgBr2+CaO![]()
本题解析:
试题分析:(I)依题意,①的生成物是②的反应物,②的生成物是③的反应物,③的生成物是④的反应物,④的反应物是HgO,则③的生成物是HgO,根据质量守恒定律可知,③的另一种反应物和生成物分别是CaO、CaBr2;(①+②+③)×2+④可得:2H2O=2H2↑+O2↑;上述4个反应都需要加热,因此消耗很多的能量才能循环制氢;上述过程中使用Hg、可溶性汞盐,它们属于重金属或重金属盐,则制氢过程能产生污染;II.(1)△H<0,说明正反应是放热反应;其它条件不变时,升高温度平衡向吸热反应方向移动,即850℃变为950℃时,平衡向逆反应方向移动,平衡常数减小,则K<1;(2)①依题意,起始时,生成物浓度幂之积与反应物浓度幂之积的比值为(1.0×5.0)/(1.0×3.0)=5/3,大于该温度下的平衡常数,说明起始时反应从逆反应方向开始进行,使生成物浓度减小、反应物浓度增大,当生成物浓度幂之积与反应物浓度幂之积的比值为1时,达到850℃时的化学平衡;②若起始时,生成物浓度幂之积与反应物浓度幂之积的比值小于1,即(1.0×x)/(1.0×3.0)<1,则0≤x<3.0;(3)设到达平衡时,H2或CO2减少amol,则CO、H2O增加amol,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始物质的量/mol????? 1.0???? 3.0?????? 1.0???? 5.0
变化物质的量/mol?????? a????? a???????? a?????? a
平衡物质的量/mol???? 1.0+a???? 3.0+a?? 1.0-a?? 5.0-a
K=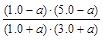 =1,解得a=0.20
=1,解得a=0.20
平衡时H2的体积分数=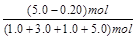 ×100% = 48%。
×100% = 48%。
本题难度:困难