微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300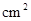 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g) 2C(g);?H=-180 kJ·
2C(g);?H=-180 kJ·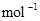
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J·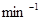 ·
·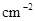 ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是_____??___。
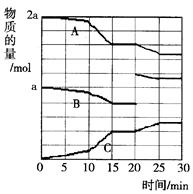
A.10~15 min可能是加入了正催化剂
B.10~15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量
参考答案:(10分)(1)0.25 mol· 本题解析:(1) v=
本题解析:(1) v=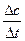 =
=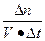 =0.25 mol·
=0.25 mol·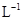 ·
·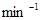
(2)每分钟体系向外散热为:0.400 KJ·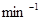 ·
·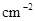 ×300=120kJ
×300=120kJ
而反应本身放热为:180 kJ·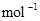 ×2/0.5=45kJ
×2/0.5=45kJ
故为了维持恒温t℃,平均每分钟需用加热器提供120-45=75kJ的热量
(3) 10~15 min时反应速率加快,加入正催化剂符合题意,但降低温度将使反应速率降低;20 min时只有B的量瞬间增大,故可能是增加了B的量,而缩小了容器体积,B的量不会瞬间增大。
本题难度:一般
2、选择题 相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol)?乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol)?丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol)?乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol)?丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
A.X的转化率为:甲<丙<乙<丁
B.X的转化率为:甲<乙<丙<丁
C.Y的转化率为:甲>丙>乙>丁
D.Y的转化率为:丁>乙>丙>甲
参考答案:A
本题解析:
试题分析:甲相当于在乙的基础上再增加X的物质的量,所以甲中Y的转化率大于乙中Y的转化率,但X的转化率要小于乙中X的转化率;丁相当于在乙的基础上再增加Y的物质的量,所以丁中X的转化率大于乙中X的转化率,但Y的转化率要小于乙中Y的转化率;丙和乙相比,相当于在增大压强。由于正方应是体积增大的可逆反应,所以平衡向逆反应方向移动,因此X或Y转化率均降低;丙和甲相比,相当于在甲的基础上再增加Y的物质的量,所以丙中X的转化率大于甲中X的转化率,但Y的转化率要小于甲中Y的转化率;丙和丁相比,相当于在丁的基础上再增加X的物质的量,所以丙中Y的转化率大于丁中Y的转化率,但X的转化率要小于丁中X的转化率。将起始时情况作如下排列:
2X(g)+Y(g) 3W(g)+2Z(g)
3W(g)+2Z(g)
甲 2 mol 1 mol
乙 1 mol 1 mol
丙 2 mol 2 mol
丁 1 mol 2 mol
X越少Y越多,X的转化率越高,则X转化率最高的为丁,最低的为甲;乙与丙相比较,丙相当于在乙的基础上再分别增加1 mol X和1 mol Y,因是恒容为加压,平衡逆向移动使X的转化率减小,故X的转化率甲<丙<乙<丁,同理得Y的转化率:丁<丙<乙<甲,因此答案选A。
本题难度:一般
3、选择题 已知1molA和nmolB按下式反应:A(g)+nB(g)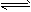 mC(g) 一段时间后,测得A的转化率为50%,同温同压下,反应前的气体密度是反应后的3/4,则n和m的值可能为[???? ]
mC(g) 一段时间后,测得A的转化率为50%,同温同压下,反应前的气体密度是反应后的3/4,则n和m的值可能为[???? ]
A.n=3 m=3
B.n=2 m=3
C.n=1 m=1
D.n=3 m=2
参考答案:CD
本题解析:
本题难度:一般
4、填空题 在一密闭容器中充入1 mol NO2,建立如下平衡:2NO2 N2O4。平衡时测得NO2的转化率为a%。其他条件不变,再充入1 mol NO2,待新平衡建立时,测得NO2的转化率为b%。则a和b的大小关系为________________。
N2O4。平衡时测得NO2的转化率为a%。其他条件不变,再充入1 mol NO2,待新平衡建立时,测得NO2的转化率为b%。则a和b的大小关系为________________。
参考答案:b>a
本题解析:浓度增大,反应速率变大,转化率增大
本题难度:简单
5、填空题 (11分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:

请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密?闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是???
CH3O(H(g)。若在恒容密?闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是???
???????????(填字母)。
a.容器内压强保持不变??? b.容器内气体密度保持不变
c.c(CO)=c(CH3OH)??? d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式:????????。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是?????????。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为???????。

(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛????g(精确到0.1,下同),甲醇厂CO的转化率为?????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般