微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
 [???? ]
[???? ]
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
参考答案:C
本题解析:
本题难度:一般
2、选择题 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);(正反应放热),当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是(????)
2HI(g);(正反应放热),当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是(????)
A.容器内气体颜色变深,平均相对分子质量变小
B.平衡不移动,混合气体密度增大
C.改变条件前后,速度图象为(如下图)
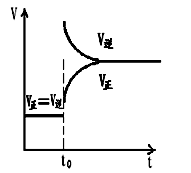
D.H2转化率增大,HI平衡浓度变小
参考答案:C
本题解析:依照题目要求,t0时改变的反应条件为升温:混合气体的总量不变,但压强增大,平衡向吸热方向移动,即左移,逆反应速率大于正反应速率,故C正确;氢气的转化率减小,HI的平衡浓度减小,排除D
平衡左移,碘蒸气浓度增大,容器内气体颜色加深,但总气体的质量、物质的量不变,所以混合气体的密度、平均分子质量不变,排除AB;
故答案为C
本题难度:简单
3、选择题 将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)  ClF3(g);△H<0。下列叙述中,正确的是
ClF3(g);△H<0。下列叙述中,正确的是
A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.6 倍
B.若 c(F2):c (ClF): c (ClF3) ="1:" 1: 1,则反应一定达到平衡状态
C.达到平衡后,若增大容器容积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
参考答案:D
本题解析:A :采用“三段式”可得出,平衡时混合气体的总物质的量为1.6 mol,压强为初始时的0.8倍
B:c(F2):c (ClF): c (ClF3) ="1:" 1: 1与是否平衡没有直接关系
C:若增大容器容积,各物质浓度均减小,正逆反应速率均减小
D:降温,平衡正向移动,气体总物质的量减小,平衡摩尔质量增大,正确
故答案为D
本题难度:一般
4、选择题 在一个固定体积的密闭容器中,加入2 mol A和1 mol B发生反应:2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )
3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )
A.4 mol A+2 mol B
B.2 mol A+1 mol B+3 mol C+1 mol D
C.3 mol C+1 mol D
D.3 mol C+1 mol D+1 mol B
参考答案:C
本题解析:由于体积不变,所以要使平衡等效,则最初投入的A、B的物质的量分别应该是2mol和1mol。由于平衡的建立和途径无关,所以选项C正确。
本题难度:一般
5、选择题 在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入?1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算
参考答案:C
本题解析:分析:铜与硝酸反应,与硫酸不反应,硫酸存在的情况下,溶液中发生离子反应3Cu+8H++2NO3-=3Cu2++2NO+3H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=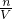 计算铜离子浓度.
计算铜离子浓度.
解答:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,
n(NO3-)n=0.4mol/L×0.1L=0.04mol.1.92g铜的物质的量为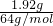 =0.03mol;
=0.03mol;
硝酸和铜反应的离子方程式如下:3Cu+8H++2NO3-=3Cu2++2NO+3H2O???????
?3Cu~~~~~8H+~~~~2NO3-~~~~3Cu2+.
?3?????????? ?8???????????2???????? 3??????????????????
0.03mol????0.08mol??????0.02mol???????
所以氢离子的物质的量不足,根据氢离子的物质的量计算,由离子方程式可知0.06mol氢离子反应,消耗铜的物质的量为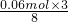 =0.0225mol;所以生成的铜离子的物质的量为0.0225mol.
=0.0225mol;所以生成的铜离子的物质的量为0.0225mol.
所以溶液中c(Cu2+)=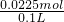 =0.225mol/L.
=0.225mol/L.
故选:C.
点评:本题考查混合物的计算,题目难度中等,根据离子方程式判断离子过量是解答本题关键.
本题难度:简单