微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是_________________。
(2)方案二:按下图装置进行实验。并回答以下问题:
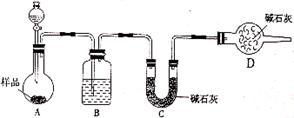
①分液漏斗中应该装___________(填“盐酸”或“稀硫酸”),D装置的作用是_________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_____________;
②若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥后的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(保留一位小数)。
参考答案:(共12分)
(1)使NaHCO3分解完全
(2
本题解析:
试题分析:(1)小苏打即NaHCO3,加热易分解,故加热至恒重的目的是使NaHCO3分解完全。
(2)①盐酸易挥发,故分液漏斗中应该装稀硫酸,碱石灰能吸收空气中的水蒸气和CO2,故D装置的作用是防止外界CO2、H2O被装置C中的碱石灰吸收。
②A生成CO2气体经B干燥后到C中进行吸收,故还需称C装置前后质量的变化。
(3)①过滤常用的玻璃仪器有烧杯、漏斗和玻璃棒。
②发生反应Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,NaHCO3+Ba(OH)2=BaCO3↓+
本题难度:一般
2、选择题 下列说法正确的是
A.少量金属Na应保存在水中
B.用萃取的方法可除去水中的Cl-离子
C.Na2SiO3溶液应保存在带玻璃塞的试剂瓶中
D.用向沸水中滴加FeCl3饱和溶液的方法可制Fe(OH)3胶体
参考答案:D
本题解析:A.少量金属Na应保存在煤油中,钠与水反应故不能保存在水中,A错误。
B.用沉淀的方法可除去水中的Cl-离子,用萃取的方法可除去水中的氯气分子,B错误。
C.Na2SiO3溶液显碱性,不能用玻璃塞,应用橡胶塞,C错误。
D.Fe(OH)3胶体的制备:将饱和FeCl3溶液滴入沸水中。D正确。
故选D
本题难度:一般
3、选择题 下面关于Na2CO3和NaHCO3性质的叙述,正确的是
A.受热时NaHCO3比Na2CO3稳定
B.在水中NaHCO3比Na2CO3溶解性大
C.质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2比Na2CO3多
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2比Na2CO3多
参考答案:C
本题解析:
试题分析:受热时Na2CO3比NaHCO3稳定;在水中Na2CO3比NaHCO3溶解性大;碳酸钠和碳酸氢钠与盐酸反应的化学方程式是:Na2CO3+2HCl="2NaCl" +H2O +CO2↑
NaHCO3+HCl="NaCl" +H2O +CO2↑由此可知,物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2和Na2CO3一样多;质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2比Na2CO3多,故选C。
点评:本题考查的
本题难度:一般
4、填空题 有一包白色粉末,取出少量溶于水,用铂丝蘸取少许溶液,在无色火焰上灼烧,火焰呈黄色,若透过蓝色钴玻璃观看,则呈浅紫色。另取少量粉末加热,没有气体产生,但加入稀盐酸后,则有无色无味的气体生成,此气体能使澄清石灰水变浑浊,继续加稀盐酸至过量后,再加入硝酸钡溶液,出现白色沉淀。试问:白色粉末中肯定含有哪几种离子?写出上述变化的离子方程式。
参考答案:含有K+、Na+、CO 本题解析:从焰色反应可知粉末中含有K+、Na+。加热无气体放出,说明无HCO
本题解析:从焰色反应可知粉末中含有K+、Na+。加热无气体放出,说明无HCO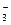 ,加入盐酸放出的无色无味气体能使石灰水变浑,说明有CO
,加入盐酸放出的无色无味气体能使石灰水变浑,说明有CO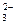 本题难度:简单
本题难度:简单
5、选择题 下面是有关Na及Na2O2性质的探究实验:
参考答案:(1)C
(2)用带火星的木条伸入试管中,木条复燃则为
本题解析:钠在空气中燃烧,受热后立即熔成小球,产生黄色火焰,生成黄色过氧化钠粉未;过氧化钠溶于水中生成强碱——氢氧化钠同时有氧气产生。比较氧化钠与过氧化钠与水、盐酸反应可知,后者总比前者多一种产物——氧气。
本题难度:一般