微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① =
= mol
mol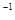
②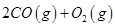 =
= mol
mol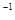
③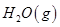 =
=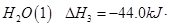 mol
mol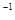
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应:
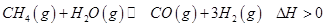
①一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则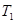
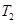 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(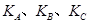 )的大小关系为 ;
)的大小关系为 ;

②100℃时,将1 mol  和2 mol
和2 mol 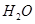 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.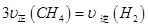
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。
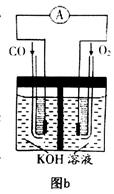
(3)某实验小组利用CO(g)、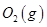 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
参考答案:(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l
本题解析:
试题分析:(1)首先写出反应的化学方程式并注明状态,然后根据盖斯定律求?H,?H=1/2×?H1—1/2?H2+2×?H3=-442.8kJ?mol?1,进而得出热化学方程式。
(2)①CH4与H2O的反应为吸热反应,温度升高,平衡向正反应方向移动,根据图像可以看出T1时CH4的转化率高,所以T1 > T2;A、B点温度相同为T1,C点温度为T2,温度较低,所以平衡常数大小关系为:KA=KB>KC。
②CH4与H2O的反应为气体系数变化,在恒容容器中进行的反应。a、若反应没有平衡,压强要发生变化,容器内的压强恒定,说明反应平衡,正确;b、消耗CH4与生成H2都是正反应方向,无法判断反应是否平衡,错误;c、因为质量守恒定律,气体的质量不变,容器体积不变,所以气体密度为定值,无法判断反应是否平衡,错误;d、正逆反应速率之比等于化学方程式的系数之比,说明正反应速率等于逆反应速率,反应达到平衡,正确;根据平衡时CH4的转化率为0.5,可求出CH4、H2O、CO、H2的平衡浓度分别为0.5mol?L?1、1.5mol?L?1,0.5mol?L?1、1.5mol?L?1,根据平衡常数表达式可求出平衡常数为:2.25(mol?L?1)2
(3)根据电池示意图,CO在负极失电子,根据化合价变化配平可得电极方程式:CO-2e?+4OH?=CO32?+2H2O
考点:本题考查热化学方程式的书写、化学平衡的判断和移动、图像的分析、化学平衡常数的计算、电极方程式的书写。
本题难度:困难
2、简答题 二甲醚(CH3OCH3)被称为21世纪的新型燃料,7清洁、高效,具有优良的环保性能.也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.请填写下列空白:
(1)二甲醚的核磁共振H谱图中有______r吸收峰,官能团名称是______.
(2)二甲醚、空气、氢氧化钾溶液、0孔石墨电极可构成燃料电池.该电池中负极的电极反应式是:CH3OCH3+16OH--12e-=2CO32-+11H2O,则正极的电极反应式是______.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=akJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=bkJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=ckJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=______kJ?mol-1.
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O
浓度/(mol?L-1)
0.64
0.二0
0.二0
①比较此时正、逆反应速率的大小:v(正)______v(逆)(填“>”、“<”或“=”),因为该时刻的浓度商9C______平衡常数400(填“>”、“<”或“=”).
②写出二甲醚(CH3OCH3)同分异构体的结构简式______.
参考答案:(了)二甲醚含有了个等效氢原子,所以它的核磁共振H谱图中有了
本题解析:
本题难度:一般
3、填空题 (18分)氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为: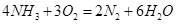 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________. 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
a.电能全部转化为化学能
b.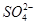 的物质的量浓度不变(不考虑溶液体积变化) 的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液 白色沉淀 白色沉淀 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
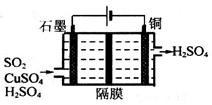
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式__________。
(3)已知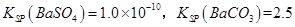 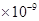 。某同学设想用下列流程得到BaCl2, 。某同学设想用下列流程得到BaCl2,
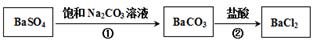
则①的离子方程式为_________,该反应的平衡常数K=__________;
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液,发生 反应 反应
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:
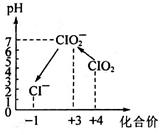
请回答:
①确定操作Ⅱ完全反应的现象是___________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________。
参考答案:(1)2NH3-6e-+6OH-=N2+6H2O;bd。(2
本题解析:
试题分析:(1)氨气燃料电池中氨气中的氮元素化合价升高,在负极反应,所以负极的电极反应为:2NH3-6e-+6OH-=N2+6H2O;a电解装置不可能将电能全部转化为化学能,还有热能,错误;b硫酸根离子在电解精炼中没有反应,不变,正确;c铜离子向阴极移动,错误;d阳极上比铜活波的金属反应,比铜不活波的金属会作为阳极泥落下来,正确;e阳极是铝、锌等先反应,所以阳极质量减少了64克,不是铜减少了64克,不能计算转移电子数,错误。所以选bd。(2)①所得的悬浊液经过过滤得到白色沉淀,在加入盐酸看沉淀是否溶解,若未溶解,说明反应过程中二氧化硫被氧气氧化成了硫酸根离子,所以反应的离子方程式为:2SO2+2Ba2++O2+2H2O=2BaSO4+4H+。②若用电解法吸收尾气中的二氧化硫,则二氧化硫在阳极失去电子变成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-(3)因为Ksp(BaSO4)<Ksp(BaCO3),所以硫酸钡可以转变成碳酸钡,BaSO4(s)+CO32-(aqs) BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
考点:电解精炼,难溶电解质的转化,氧化还原反应
本题难度:困难
4、填空题 (4分)(1)已知:一定量CH4完全燃烧生成CO2和液态水时,放出热量QkJ;若将燃烧产物全部通入过量的澄清石灰水,可得到20g沉淀,请写出CH4燃烧的热化学方程式
(2)请写出:氢氧燃料电池的正极电极反应式(电解质溶液为稀硫酸)
参考答案:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l
本题解析:(1)20g沉淀是碳酸钙,物质的量是0.2mol,所以根据碳原子守恒可知燃烧生成的CO2也是0.2mol。所以生成1molCO2放出的热量是5QkJ,因此热化学方程式为
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -5QkJ/mol。
(2)原电池正极是得到电子的,所以在氢氧燃料电池中氧气在正极通入,由于溶液显酸性,所以正极电极反应式为O2+4H++4e-=2H2O。
本题难度:一般
5、填空题 下图为原电池的示意图。请回答:

(1)Zn极为原电池的????????(填“正”或“负”)极,该极的电极反应式是?????????????????????????,属于???????????????????(填“氧化反应”或“还原反应”)。
(2)???????(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中的H+从????????(填“锌片”或“铜片”)获得电子
参考答案:(1)负极;Zn-2e-=Zn2+??氧化反应???(2)电
本题解析:考查原电池的判断。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜正极,溶液中的氢离子在正极得到电子,生成氢气。
本题难度:一般
|