微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述是小明做完铜锌原电池的实验后得出的结论和认识,你认为正确的是? [???? ]
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
参考答案:D
本题解析:
本题难度:一般
2、填空题 (9分)(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

①B中Sn极的电极反应式为__________________,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)__________。
②A中总反应离子方程式为__________。比较A、B、C中铁被腐蚀的速率,由快到慢 的顺序是________。
的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
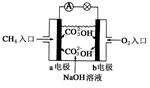
①电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。
②电池工作一过程中正极pH______,负极pH值_______,一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
参考答案:(1)①2H+ +2e- =H2??增大?②Fe+2H+=F
本题解析:略
本题难度:一般
3、选择题 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒
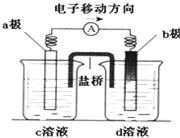
参考答案:Zn+H2SO4=ZnSO4+H2↑设计成原电池,根据化合价
本题解析:
本题难度:简单
4、填空题 (1)将一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片,可观察到铜片上______(填“有”或“没有”)气泡产生.用导线将锌片和铜片连接起来(如图a所示),可观察到铜片上______?(填“有”或“没有”)气泡产生.
(2)用导线连接灵敏电流计的两端后,再与溶液中的锌片和铜片相连接(如图b所示),观察到灵敏电流计的指针发生偏转,说明导线中有电流通过.从上述现象可以归纳出构成原电池的某些条件是:______,电极反应式是:锌片______;铜片______.
(3)可见,图b是一个将______能转化为______能的装置,被称为原电池.我们也可以用家庭常见的一些仪器和物品,自制一个原电池,请你尝试涉及实验,并将你所设计的原电池简图画在右面的方框内:
所需物品及仪器:______.
实验操作步骤及现象:______.

参考答案:(1)铜片和酸不反应,且铜片上也没有自由电子,所以没有气泡产
本题解析:
本题难度:一般
5、选择题 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )。
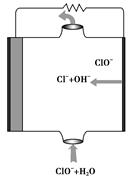
A.放电过程中OH-移向正极
B.电池的总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应为:H2O2+2H++2e-=2H2O
参考答案:A
本题解析:根据图像判断反应过程,判断正、负极,正确书写电极反应式。镁燃料电池,镁作负极失电子,产物由电解质溶液决定,若为酸性溶液生成Mg2+,碱性溶液生成Mg(OH)2。ClO-在正极反应,由图可知有Cl-和OH-生成,OH-向负极移动,生成Mg(OH)2。
本题难度:一般