微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某兴趣小组同学取用80.00 g的MgCl2溶液(含镁元素质量分数为15.00%),将其小心蒸干得49.25 g固体(其成分表示为Mgx(OH)yClz?nH2O),为研究其组成进行了如下两实验:
实验一:将所得固体全部溶于100 mL? 1.50 mol·L-1的硝酸中,再加水稀释至500 mL,测得溶液的c(H+)=0.1mol·L-1;
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是???????????;(填字母序号)
A.均要做,否则无法计算 B.均不要做,数据已经足够 C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
参考答案:①C(2分)
②n(Mg2+)=0.5mol, n (
本题解析:略
本题难度:一般
2、选择题 下列关于铝及其化合物的说法正确的是
A.铝制品在生活中被广泛使用,说明铝是一种不活泼的金属
B.氧化铝的熔点很高,是一种较好的耐火材料
C.Al(OH)3碱性很强,故可用于治疗胃酸过多
D.铝是地壳中含量最多的元素
参考答案:B
本题解析:A:铝是一种活泼金属,表面在常温下即可被氧化为致密的氧化膜,阻止它继续氧化,不正确
B:正确
C:Al(OH)3为两性氢氧化物,碱性较弱,不正确
D:铝是地壳中含量最多的金属元素,不正确
答案为B
本题难度:简单
3、填空题 (12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
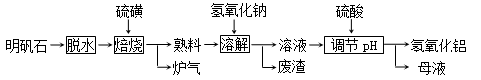
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  ?2Al 2O3+9SO2,其中氧化剂为???????????。
?2Al 2O3+9SO2,其中氧化剂为???????????。
(2)“溶解”时反应的离子方程式为???????????。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
???????????。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
???????????mL
(5)“废渣”、“母液”中可回收的物质分别是???????????。
参考答案:(12分)(1)Al2(SO4)3(2分)?(2)Al2O3
本题解析:此题为工艺流程题,涉及工艺流程、实验操作、反应理论等。(1)焙烧过程中发生的是一个归中反应S从+6和0到+4价,得到熟料中有K2SO4和Al2O3,用NaOH溶解,将Al2O3转化为NaAlO2,然后调节pH,AlO+H++H2O=Al(OH)3。882g/L的硫酸,物质的量浓度为9mol/L,98%的硫酸为18mol/L,从而计算需要体积为500ml。
本题难度:一般
4、填空题 某学习小组用题27图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(1)A中试剂为????????????????????.

(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是????????????????????.
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是??????????;(填序号)记录C的液面位置时,除视线平视外,还应????????.
(4)B中发生反应的化学方程式为???????????????? .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为?????????????.
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将???????????.(填“偏大”、“偏小”、“不受影响”)
参考答案:(1)NaOH溶液.(2)除去铝镁合金表面的氧化膜.(3)⑤
本题解析:(1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量。(2)由于Al表面容易生成氧化膜,因而要用酸处理。(3)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录未读数,两将相减即为产生H2的量;最后称得的固体即为Mg的质量。在读数时要注意D、C液面相平,否则气体将受压,超成读数不准。(4)B中发生的是Al与碱的反应;(5)(a-c)即为铝的质量,再除以Al的物质的量即为
本题难度:一般
5、选择题 甲、乙两烧杯中分别盛有10mL?1mol?L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水.下列有关两个烧杯的说法中,正确的是
A.甲中产生的沉淀一定比乙中多
B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多
D.甲和乙中产生的沉淀可能一样多
参考答案:D
本题解析:分析:根据氢氧化铝的性质,其能溶于氢氧化钠但不溶于氨水,故开始加入时,两烧杯中生成的都是氢氧化铝沉淀;
相同体积、相同pH的两溶液中的溶质一水合氨大于氢氧化钠:
当两者均不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠恰好时,生成的沉淀一样多;
氨水和氢氧化钠都过量时,生成的沉淀氨水多.
解答:因氨水和NaOH溶液中,各加入10mL?0.1mol?L-1?AlCl3溶液,生成氢氧化铝沉淀,但氨水为弱电解质,部分电离,氢氧化钠为强电解质,完全电离,相同体积、相同pH的氨水和NaOH溶液中的溶质一水合氨的物质的量大于氢氧化钠的物质的量;
当两者都不足量时,生成的氢氧化铝沉淀的量由一水合氨和氢氧化钠来决定,一水合氨的物质的量大于氢氧化钠的物质的量,所以甲中沉淀比乙中的少;
?当氨水过量,氢氧化钠不足时,乙中生成的氢氧化铝的物质的量为10mL×10-3L/mL×0.1mol?L-1=0.001mol,甲中生成的氢氧化铝的物质的量小于0.001mol,所以甲中沉淀比乙中少;
当氨水过量,氢氧化钠恰好时,生成的沉淀取决于氯化铝,氯化铝的量相等,所以甲和乙中生成的沉淀一样多;
当氨水和氢氧化钠都过量时,因氢氧化铝能溶于氢氧化钠但不溶于氨水,乙中生成的氢氧化铝为0.001mol,甲中生成的氢氧化铝溶于过量的氢氧化钠,氢氧化铝沉淀小于0.001mol,所以甲中沉淀比乙中少.
通过以上分析知,甲中沉淀少于或等于乙中沉淀,故ABC错误、D正确;
故选D.
点评:本题考查了铝化合物性质、化学计算等,此题解答时,根据氢氧化铝的性质采用讨论的方法进行解答,能正确进行分段是解本题的关键,难度较大.
本题难度:一般