微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l) NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
A.在液氨中加入NaNH2,可使液氨的离子积变大
B.在液氨中加入NH4Cl,液氨的离子积不变
C.此温度下液氨的离子积K为1×10-30
D.在液氨中加入金属钠可能有NaNH2生成
参考答案:A
本题解析:
试题分析:仔细观察液氨的电离方程式,不难发现液氨的电离类似于水的电离,均属于“质子(H+)转移自电离”, 其中NH4+和NH2-分别相当于纯水中水电离出的H3O+和OH-。由此类比推出,液氨的性质应类似于水,如液氨可以与金属钠反应生成H2和NaNH2;影响液氨电离平衡的因素也类似于水。液氨的离子积(也应该只是温度的函数)为常数,此温度下会恒等于1×10-30。故选项A不正确,BCD正确,答案选A。
点评:本题考查弱电解质的电离,难度适中,考查学生对已有知识的迁移,应用知识的能力。
本题难度:简单
2、选择题 工业生产苯乙烯是利用乙苯的脱氢反应:

下列说法错误的是
A.该反应中生成物的总能量高于反应物
B.增大压强反应物活化分子百分数不变
C.升高温度可以提高原料乙苯的转化率
D.不断分离出苯乙烯可加快反应速率
参考答案:D
本题解析:
试题分析:A、正确,生成物的总能量=反应物的总能量+吸收的能量;B、正确,增大压强,相当于增大了浓度,活化分子数目增大,没有改变活化分子百分数。C、正确,本反应是吸热反应,升高温度平衡正向移动,可以提高原料乙苯的转化率;D、不正确,不断分离出苯乙烯,生成物浓度降低,反应速率降低。选D。
本题难度:一般
3、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
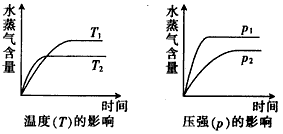 [???? ]
[???? ]
A. CO2(g)+2NH3(g)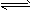 CO(NH2)2(s)+H2O(g); △H<0
CO(NH2)2(s)+H2O(g); △H<0
B. CO2(g)+H2(g)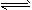 CO(g)+H2O(g); △H>0
CO(g)+H2O(g); △H>0
C. CH3CH2OH(g)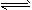 CH2=CH2(g)+H2O(g); △H>0
CH2=CH2(g)+H2O(g); △H>0
D. 2C6H5CH2CH3(g)+O2(g)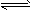 2C6H5CH=CH2(g)+2H2O(g); △H<0
2C6H5CH=CH2(g)+2H2O(g); △H<0
参考答案:A
本题解析:
本题难度:一般
4、选择题 在下列可逆反应中,增大压强或降低温度,均可使化学平衡向正反应方向移动的是[???? ]
A.2SO2+O2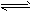 2SO3(g)(正反应是放热反应)
2SO3(g)(正反应是放热反应)
B.4NH3+5O2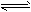 4NO+6H2O(g)(正反应是放热反应)
4NO+6H2O(g)(正反应是放热反应)
C.2NH3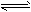 N2+3H2(正反应是吸热反应)
N2+3H2(正反应是吸热反应)
D.SO2+NO2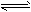 SO3(g)+NO(正反应是放热反应)
SO3(g)+NO(正反应是放热反应)
参考答案:A
本题解析:
本题难度:一般
5、填空题 (14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
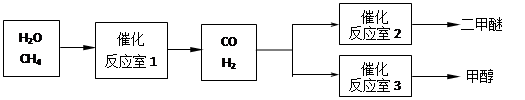
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)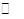 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)= mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为2L)中 0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:

①P1 P2 (填“<”、“>”或“=”)。
②在P1压强下,100℃时,反应CO(g)+2H2(g)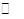 CH3OH(g)的平衡常数K的值为
CH3OH(g)的平衡常数K的值为
若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”)。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率 (填“增大”、“不变”或“减小”),c(CH3OH) 0.1mol/L(填“>”、“<”或“ = ”)
参考答案:(1)减小(1分) 0.03mol·L-1·min-1(2
本题解析:(1)降低温度,反应速率一定是减小的。根据方程式可知,0.1molCO生成,则同时生成氢气0.3mol,所以氢气的反应速率是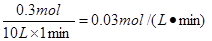 。
。
(2)根据反应物和生成物并结合原子守恒可知,反应的方程式为
2CO+4H2 CH3OCH3+H2O。
CH3OCH3+H2O。
(3)①根据方程式可知,该反应是体积减小的。因此增大压强,平衡向正反应方向移动,CO的转化率增大,所以根据图像可判断,P1小于P2。
②根据图像可知,在P1压强下,100℃时,CO的转化率是0.5,所以平衡时生成甲醇0.1mol,浓度是0.05mol/L。剩余CO和氢气分别是0.1mol和0.2mol,浓度分别是0.05mol/L和0.1mol/L。因此平衡常数是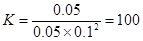 ;再加入CO,则平衡向正反应方向移动,但CO的转化率降低;如果此时氢气全部转化,则生成甲醇是0.2mol,剩余CO是1mol,则甲醇的含量是1/6<1/4,即甲醇的含量是降低的。
;再加入CO,则平衡向正反应方向移动,但CO的转化率降低;如果此时氢气全部转化,则生成甲醇是0.2mol,剩余CO是1mol,则甲醇的含量是1/6<1/4,即甲醇的含量是降低的。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,则相当于增大压强,平衡向正反应方向移动,CO的转化率增大,甲醇的浓度大于0.1mol/L。
本题难度:困难