微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质
| X
| Y
| Z
| W
|
初始浓度/mol·L-1
| 0.5
| 0.6
| 0
| 0
|
平衡浓度/mol·L-1
| 0.1
| 0.1
| 0.4
| 0.6
?
A.反应达到平衡时,X的转化率为80%?
B.该反应的平衡常数表达式为K=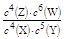
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:
试题分析:根椐化学计量数的比为反应速率之比,可知,该题中反应物是X和Y,生成物是Z和W,可知化学计量数为:4、5、4、6,也是说反应方程式为:4X+5Y 4Z+6W。可知,当增大压强时,平衡向逆向移动,使得Z的含量减少。因此C错误。 4Z+6W。可知,当增大压强时,平衡向逆向移动,使得Z的含量减少。因此C错误。
本题难度:一般
2、填空题 (8分) A(g)+2B(g)  2C(g)的反应中,时间t与C的体积分数(C%)的函数关 2C(g)的反应中,时间t与C的体积分数(C%)的函数关
系如图所示。回答下列问题:
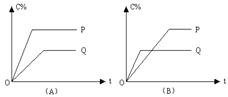
(1)图A中若两条曲线分别表示在100℃和400℃时的C%与时间t的函数关系,则P表示的温度为 ℃,
从P、Q分析反应A(g)+2B(g)  2C(g)是 反应(填“吸热”或“放热”); 2C(g)是 反应(填“吸热”或“放热”);
(2)图B中P表示的温度为 ℃,反应A(g)+2B(g)  2C(g)是 反应(填“吸热”或“放热”)。 2C(g)是 反应(填“吸热”或“放热”)。
参考答案:(1)400℃ 吸热(2)100℃&#
本题解析:(1)温度高,反应速率快,达到平衡的时间少,P曲线首先达到平衡状态,所以P表示400℃。温度高,C的含量也高,说明升高温度,平衡向正反应方向移动,所以正反应是吸热反应。
(2)根据图像可知,Q曲线首先达到平衡状态,所以Q表示的是400℃,因此P表示的是100℃。温度低,C的含量高,说明降低温度,平衡向正反应方向移动,所以正反应是放热反应。
本题难度:一般
3、选择题 下列关于化学反应限度的叙述中正确的是( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
参考答案:A、改变影响化学平衡的条件,化学平衡被破坏,平衡移动,即改变
本题解析:
本题难度:简单
4、选择题 在两个恒容容器中有平衡体系:A(g)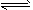 2B(g)和2C(g) 2B(g)和2C(g) D(g),X1和X2分别是A和C的转化率。在温度不变情况下,均增加相同的A和C的物质的量,下列判断正确的是[???? ] D(g),X1和X2分别是A和C的转化率。在温度不变情况下,均增加相同的A和C的物质的量,下列判断正确的是[???? ]
A.X1降低,X2增大
B.X1.X2均降低
C.X1增大,X2降低
D.X1.X2均增大
参考答案:A
本题解析:
本题难度:一般
5、简答题 )氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298K | 398K | 498K | …
K
4.1×106
K1
K2
…
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”).
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是______(填序号).
a.2v(H2)正=3v(NH3)逆b.v(N2)正=3v(H2)逆
c.容器内压强保持不变d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡向______方向移动.
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)______Ksp(AgBr)(填“>”“=”或“<”).
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①298K时,1.00gN2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式______.
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式______.
参考答案:(1)①N2(g)+3H2(g)?2NH3(g)△H<0,反
本题解析:
本题难度:简单
|
|