微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下某溶液中,水电离出的C(OH-)=10-4mol/L,该溶液中的溶质可能是
A.硫酸铝
B.醋酸钠
C.氢氧化钠
D.硫酸氢钠
参考答案:B
本题解析:常温下由水电离出的C(OH-)=10-4mol/L,说明所加的溶质促进水的电离,结合选项知,只能是水解呈碱性的强碱弱酸盐醋酸钠。
本题难度:一般
2、选择题 下列电离方程式中,正确的是
A.Al2(SO4)3 == 2Al+3 + 3SO4-2
B.Na2CO3==Na2+ + CO32-
C.NaOH == Na+ + OH-
D.NaHCO3 ==Na+ + H+ + CO32-
参考答案:C
本题解析:试题分析:A不正确,应该是Al2(SO4)3 =2Al3++ 3SO42-;B不正确,应该是Na2CO3==2Na+ + CO32-;D不正确,应该是NaHCO3 =Na+ + HCO3-,所以正确的答案选C。
考点:考查电离方程式的正误判断
点评:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式。书写电离方程式时应特别注意:
①写出物质正确的化学式是正确书写电离方程式的基础。
②要正确书写出电离的阳离子、阴离子的符号。这里注意区分离子符号和化合价的书写。离子所带电荷的数目应标在元素符号的右上角,且要先写数字,后写“+”或“-”号;化合价标在元素符号的正上方,先写“+”或“-”号,后写数字。离子的电荷数为1时,1省略不写,只写“+”或“-”号;而化合价数为1时,1必须标明。
③含有原子团的物质电离时,原子团应作为一个整体,不能分开。
④表示离子数目的数字要写在离子符号的前面,不能像在化学式里那样写在右下角。
⑤在电离方程式中,阴阳离子所带正负电荷的总数必须相等。
⑥酸碱盐电离出的阴、阳离子的个数应与其化学式中相应原子或原子团的个数相同,电离出的离子所带的电荷数应与该元素或原子团的化合价数值相等。
⑦强酸的酸式根离子中氢离子需要分开,而弱酸的酸式根离子中氢离子不能分开。
本题难度:一般
3、选择题 现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
A.N溶液与过量的F溶液反应的离子方程式: Ba2++SO42-=BaSO4↓
B.E溶液与N溶液混合发生反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-=CO2↑+H2O
参考答案:B
本题解析:试题分析:根据题意推导可知:E为Na2CO3,N为Al2SO4,F为Ba(OH)2,G为H2SO4,M为AgNO3。A、还有AlO2-生成,错误;B、正确;C、二者溶液混合生成AgOH能溶于氨水,错误;D、等体积等浓度混合生成HCO3-,错误。
考点:考查了离子方程式的书写。
本题难度:一般
4、选择题 氮化铝 (AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3 + N2 + 3C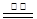 2AlN + 3CO合成。下列叙述正确的是
2AlN + 3CO合成。下列叙述正确的是
A.该反应中氧化剂与还原剂物质的量之比为3:1
B.AlN是还原产物
C.AlN的摩尔质量为41g
D.上述反应中,每生成lmolAlN需转移6mol电子
参考答案:B
本题解析:
试题分析:从方程式中元素的化合价的改变知道N2是氧化剂,C是还原剂,A错;AlN是N2被C还原得到的产物,是还原产物,B对;摩尔质量的单位是g/mol,C错;Al2O3 + N2 + 3C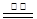 2AlN + 3CO方程式中知道每生成2分子AlN转移电子数为6e-, 每生成lmolAlN需转移3mol电子,D错;选B
2AlN + 3CO方程式中知道每生成2分子AlN转移电子数为6e-, 每生成lmolAlN需转移3mol电子,D错;选B
考点:氧化还原反应中氧化剂、还原剂,氧化产物、还原产物的判断,电子的转移的计算。
本题难度:一般
5、选择题 常温下,某CH3COONa与CH3COOH的混合溶液的pH=7,则下列离子浓度之间的关系错误的是
A.c(Na+)>c(CH3COO-)
B.c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.c(Na+)D.c(Na+)
参考答案:AC
本题解析:溶液中只有四种离子,遵循电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则BD均正确,由于pH=7,则c(H+)=c(OH-),进而可知c(Na+)=c(CH3COO-),AC不正确
本题难度:简单