0
1
①
2
②
③
④
3
⑤
⑥
⑦
⑧
4
⑨
用表中的①~⑨九种元素及其化合物,填写下列空白:
(1)②号元素的元素符号为______.
(2)非金属性最强的元素是______(填元素符号).
(3)常用来做半导体材料的元素是______(填元素符号).
(4)最高价氧化物的水化物中,碱性最强的是______(填化学式).
(5)最高价氧化物是两性氧化物的是______(填化学式).
(6)⑤、⑧两元素形成的化合物的电子式为______.
参考答案:由元素在周期表中的位置可知,①为H,②为N,③为F,④为Ne
本题解析:
本题难度:一般
2、推断题 (三选一)【物质结构与性质】
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的电子排布式:________, F位于周期表____区。
(2)A、B、C的第一电离能由小到大的顺序为____。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
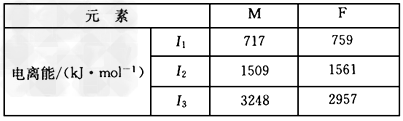
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是_____________________
(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为________,一个晶胞中F原子的数目为_________。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下
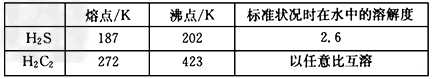
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是____________
参考答案:(1)1s22s22p63s23p63d64s2;d
本题解析:
本题难度:一般
3、填空题 看表填空。

(1)写出(1)-(10)号元素的元素符号:(1)______(2)_____(3)______(4)______(5)______(6)______(7)_______(8)______(9)________(10)______。并指出能成共价键的元素有______种。
(2)(1)、(5)、(9)号元素,相互化合时可形成_______化合物,但溶于水后也可以电离出_______离子和
_______离子。
(3)(8)、(10)号元素化合时,可通过_______键形成_______化合物。
(4)(1)、(5)、(7)号元素相互化合形成的物质中,既有_______键,又有_______键,它的俗称有
_______、_______、_______。
(5)可形成双原子分子的单质有(写化学式):_______、_______、_______、________、_______,原子间以________键结合。
(6)可形成最稳定气态氢化物的元素是________。
(7)(1)、(4)号元素形成的气态氢化物溶于水后,溶液呈_______性,(1)、(10)号元素形成的气态氢化物溶于水后溶液呈_______性。
(8)(3)、(5)、(7)号元素相互化合可形成_______化合物。该物质俗称为_______,但属于_______类物质。
(9)分子中含有18个电子的气态氢化物有____种,分别写出化学式________,将分子中含10个电子的气态氢化物的化学式分别写出:_____、_____、______、_______。
(10)含氧量最高的离子化合物和共价化合物分别是(填化学式)_______和________。
(11)10种元素中化学性质最不活泼的是________。
(12)(3)、(7)、(9)三种元素的最高氧化物的水化物中,碱性由强到弱的顺序是________。
参考答案:(1)H;He;C;N;O;F;Na;Mg;S;Cl;7 <
本题解析:
本题难度:一般
4、选择题 下列有关物质性质的说法正确的是( )
A.元素的最高正价在数值上等于它所在的族序数
B.同周期主族元素的原子半径越小,越难失去电子
C.元素的非金属性越强,它的气态氢化物水溶液的酸性越强
D.酸性:H2SO4>H2SiO3>H2CO3
参考答案:A、大多数元素的最高正价在数值上等于它所在的族序数,但是氟元
本题解析:
本题难度:一般
5、选择题 下列各组物质的性质变化正确的是( )
A.酸性HClO4>H3PO4>HNO3>H2SiO4
B.稳定性H2S>HCl>HBr>HI
C.还原性Rb>K>Na>Li
D.碱性Al(OH)3>Mg(OH)2>NaOH
参考答案:A.非金属性Cl>N>P>Si,元素的非金属性越强,对应的最
本题解析:
本题难度:一般
|