微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。下列说法不正确的是 [???? ]
A.若反应过程中转移了0.3 mol电子,则参加反应的HNO3的物质的量是0.1 mol
B.H2S、HNO3为反应物,S、NO、H2O为生成物
C.H2S为还原剂,HNO3为氧化剂
D.该反应可以说明HNO3的酸性比氢硫酸强
参考答案:D
本题解析:
本题难度:简单
2、选择题 反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:Mn02>SO42->I03->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
参考答案:A.在反应①中硫元素既不被氧化也不被还原,在反应②中被氧化,
本题解析:
本题难度:简单
3、选择题 下列关于甲、乙、丙、丁四个图像的说法中,正确的是
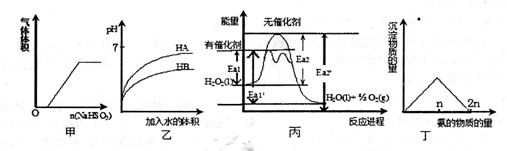
A.甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图像
B.乙是等pH的HA和HB两种弱酸溶液稀释时pH变化图,由此可知HA的酸性弱于HB
C.由丙可知,双氧水在有催化剂存在时的热化学方程式为
2H2O2(1)="2H" 2O(l)+O2(g) △H=-2(Ea2’-Ea2) kJ·mol-l
D.丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图
参考答案:C
本题解析:
试题分析:A、亚硫酸氢钠和稀硝酸发生氧化还原反应,稀硝酸还原成NO气体,开始就有气体生成,故A错误;等pH的HA和HB两种弱酸溶液稀释时,pH变化大的为酸性较强的酸,HA酸性较强,故B错误;C、反应放出的热量为反应物具有的能量和生成具有的能量之差,故C正确;D、硝酸银溶液中滴加氨水,先发生:AgNO3+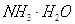
本题难度:一般
4、选择题 下列根据实验操作和现象所得出的结论正确的是
选项
| 实验操作
| 实验现象
| 结论
|
A
| 向某溶液中加入盐酸酸化的BaCl2溶液
| 生成白色沉淀
| 该溶液中一定含有SO42—
|
B
| 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水
| 实验现象1:
上层溶液不变红,
下层溶液紫红色
实验现象2:
上层溶液变红
| 氧化性:Br2>Fe3+>I2
|
C
| 取久置的Na2O2粉末,向其中滴加过量的盐酸
| 产生无色气体
| Na2O2没有变质
|
D
| 将一片铝箔置于酒精灯外焰上灼烧
| 铝箔熔化但不滴落
| 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al
参考答案:BD
本题解析:
试题分析:A、若溶液中存在Ag+,则也会有白色沉淀生成,错误;B、根据氧化还原反应的先后规律,同一氧化剂与不同还原剂反应时还原性强的先发生反应,所以实验现象表明,溴先氧化碘离子,亚铁离子未被氧化,说明碘离子的还原性强于亚铁离子,再根据物质氧化性、还原性的变化关系,所以氧化性:Br2>Fe3+>I2,正确;C、若过氧化钠变质则生成碳酸钠,加入稀盐酸同样有气体产生,需进一步检验气体,才能确定过氧化钠是否变质,错误;D、铝的表面与氧气生成一层致密的氧化物薄膜,氧化物的熔点高于铝的熔点,包裹在外面,才使得熔化的铝不滴落,正确,答案选BD。
考点:考查离子的检验,氧化性的比较,物质性质的判断
本题难度:一般
5、选择题 从海水中可以提取溴的主要反应为:2Br-+Cl2 = 2Cl-+Br2,下列说法正确的是 [???? ]
A.Br-具有氧化性
B.Cl2是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴强
参考答案:D
本题解析:
本题难度:简单
|