微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3?5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml????乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
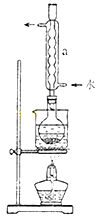
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3?5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是???????????????????????????????????????????????。
(2)仪器a的名称是???????????,其作用是?????????????????????????????????????????。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是??????????????????????????????,检验是否存在该杂质的方法是???????????????????????????????????????????????????????。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:????????????????
?????????????????????????????????????????????????????????????????????????????????????。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol?L?1碘的标准溶液滴定。
反应原理为:2S2O32?+I2=S4O62-+2I?
(5)滴定至终点时,溶液颜色的变化:???????????????????????????????????。
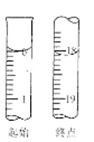
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为????????mL。产品的纯度为(设Na2S2O3?5H2O相对分子质量为M)???????????。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42?,常用作脱氧剂,该反应的离子方程式为?????????????????????????????????????????????????????????????。
2、填空题 钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:
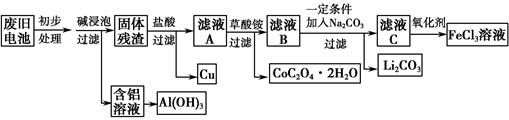
(1)碱浸泡过程中,铝被溶解的离子方程式为__________________________
(2)滤液A中加入草酸铵溶液,使Co元素以CoC2O4·2H2O沉淀形式析出。草酸钴是制备氧化钴及钴粉的重要原料。在空气中CoC2O4·2H2O的热分解失重数据见下表,请补充完整表中的热分解方程式。
序号
| 温度范围/℃
| 热分解方程式
| 固体失重率
|
①
| 120~220
| ?
| 19.67%
|
②
| 280~310
| ?
| 56.10%
?
(3)过滤Li2CO3时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_____________________________________________________________
(4)最终所得的FeCl3溶液可作净水剂,试结合离子方程式解释其净水原理________________________________________________________
3、选择题 下列除去杂质的实验方法正确的是
A.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
B.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤
C.除去FeC13酸性溶液中少量的FeC12:加入稍过量双氧水后放置
D.除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤
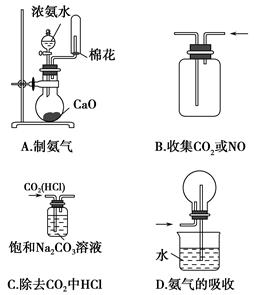
4、选择题 下列实验操作正确的是????????????? ( )。
5、选择题 海水淡化方法较多,下列方法中也可以用来进行海水淡化的是
A.过滤法
B.萃取法
C.分液法
D.冰冻法
|