微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.把纯水加热,水的电离程度增大,但水仍然是中性的,pH=7
B.在醋酸溶液中加入少量的CH3COONa(s),测得pH变大,主要原因是CH3COONa水解呈碱性,中和醋酸电离的H+
C.pH=3的醋酸溶液,稀释至10倍后pH<4
D.相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小
参考答案:C
本题解析:
试题分析:水的电离是吸热过程,升高温度,促进水的电离,但c(OH-)=c(H+),水仍然呈中性,但pH减小,A错误;CH3COOH CH3COO-+H+,向醋酸溶液中加入醋酸钠固体,c(CH3COO-)增大,平衡向左移动,c(H+)减小,pH增大,B错误;pH=3的醋酸中c(H+)=10-3mol/L,稀释至10倍后,CH3COOH继续电离补充H+,所以c(H+)>10-4mol/L,pH<4,C正确;酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:Na2CO3>CH3COONa,D错误。
CH3COO-+H+,向醋酸溶液中加入醋酸钠固体,c(CH3COO-)增大,平衡向左移动,c(H+)减小,pH增大,B错误;pH=3的醋酸中c(H+)=10-3mol/L,稀释至10倍后,CH3COOH继续电离补充H+,所以c(H+)>10-4mol/L,pH<4,C正确;酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:Na2CO3>CH3COONa,D错误。
考点:水的电离 弱电解质的电离平衡 溶液的稀释与pH 盐类的水解
点评:pH相同的弱酸与强酸稀释相同的倍数后,强酸pH变化大,因稀释过程中弱酸继续电离补充H+。同理,pH相同的强碱与弱碱稀释相同的倍数后,强碱pH变化大。
本题难度:困难
2、选择题 某物质溶液的pH=3,若加水稀释使溶液体积变为原来的10倍,所得溶液的pH: 3<pH<4,则该物质可能是 ( )
A.H2S
B.HCl
C.CH3COONa
D.NH4Cl
参考答案:AD
本题解析:
正确答案:AD
pH=3,若加水稀释使溶液体积变为原来的10倍,所得溶液的pH: 3<pH<4,说明该溶液是弱酸或弱酸性物质,H2S,NH4Cl符合题意。B、稀释后pH=4;C、呈碱性。
本题难度:一般
3、选择题 常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:B
本题解析:
试题分析:硫酸是二元强酸,溶液中氢离子的浓度是0.12mol/L,所以硫酸是过量的,则反应后溶液中氢离子的浓度是 ,所以pH=2,答案选B。
,所以pH=2,答案选B。
考点:考查pH的有关计算
点评:该题是高考中的常见题型,属于基础性试题的考查。该题难度不大,学生不难得分。该题的关键是首先判断出硫酸过量,然后直接列式计算即可。
本题难度:一般
4、填空题 写出下列物质在水溶液中的电离方程式:
(1)NH4NO3______.
(2)K2SO4______,
(3)NaHSO4______.
参考答案:(1)NH4NO3是强电解质水溶液中完全电离,NH4NO3=
本题解析:
本题难度:一般
5、选择题 下列溶液,按 由小到大顺序排列的是
由小到大顺序排列的是
① 溶液 ②
溶液 ②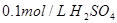 溶液
溶液
③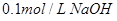 溶液 ④
溶液 ④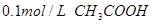 溶液
溶液
A.①②④③
B.②①④③
C.③④①②
D.④③②①
参考答案:B
本题解析:
试题分析:①中氢离子的浓度是0.1mol/L,pH=1;②中氢离子的浓度是0.2mol/L,pH小于1;③中倾注了的浓度是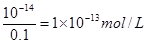 ,pH=13;醋酸是弱酸,所以0.1mol/L醋酸溶液中,氢离子的浓度小于0.1mol/L,pH大于1,所以正确的答案选B。
,pH=13;醋酸是弱酸,所以0.1mol/L醋酸溶液中,氢离子的浓度小于0.1mol/L,pH大于1,所以正确的答案选B。
考点:考查pH的有关计算
点评:由于氢离子浓度的负对数是pH,所以氢离子的浓度越大,pH越小,反之越大。
本题难度:一般