微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W2-、X+
B.X+、Y3+
C.Y3+、Z2-
D.X+、Z2-
参考答案:C
本题解析:
试题分析:根据题意及形成的两种的结构可知W是是O; X是Na; Y是Al;Z是S.其中Na+不会破坏水的电离平衡,因此选项A、B、D排除,而O2-、Al3+、S2-会消耗水电离产生的H+或OH-,因此都能破坏水的电离平衡,故选项是C。
考点:考查元素的推断及元素形成的简单离子对水的电离平衡移动的影响的知识。
本题难度:一般
2、实验题 (8分)阅读下列实验内容,根据题目要求回答问题。
实验室中有一未知浓度的稀盐酸,某学生用0.100mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
实验编号
| 待测盐酸的体积(mL)
| NaOH溶液的浓度(mol·L-1)
| 滴定完成时,NaOH溶液滴入的体积(mL)
|
1
| 20.00
| 0.10
| 24.18
|
2
| 20.00
| 0.10
| 23.06
|
3
| 20.00
| 0.10
| 22.96
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
参考答案:(1)滴入最后一滴氢氧化钠溶液,溶液由无色恰好变为粉红色且半
本题解析:
试题分析:(1)滴定终点判断的标准为滴入最后一滴液体,溶液颜色变化,且半分钟内不褪色。(2)三次平均消耗氢氧化 钠溶液的体积为23.4mL;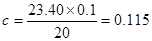 mol/L;(3) 滴定管的精度为0.01 mL,所以读数为22.30 mL;(4) 水洗后未用待测盐酸润洗,盐酸浓度减小;锥形瓶水洗后未干燥,锥形瓶内溶质的物质的量不变,消耗氢氧化钠的体积不变,故对浓度无影响;称量NaOH固体时,有小部分NaOH潮解,氢氧化钠浓度减小,所以消耗氢氧化钠的体积增大,故测得盐酸浓度大;滴定终点读数时俯视,消耗氢氧化钠的体积增小,故测得盐酸浓度小;碱式滴定管尖嘴部分有气泡,滴定后消失,消耗氢氧化钠的体积增大,故测得盐酸浓度大; mol/L;(3) 滴定管的精度为0.01 mL,所以读数为22.30 mL;(4) 水洗后未用待测盐酸润洗,盐酸浓度减小;锥形瓶水洗后未干燥,锥形瓶内溶质的物质的量不变,消耗氢氧化钠的体积不变,故对浓度无影响;称量NaOH固体时,有小部分NaOH潮解,氢氧化钠浓度减小,所以消耗氢氧化钠的体积增大,故测得盐酸浓度大;滴定终点读数时俯视,消耗氢氧化钠的体积增小,故测得盐酸浓度小;碱式滴定管尖嘴部分有气泡,滴定后消失,消耗氢氧化钠的体积增大,故测得盐酸浓度大;
考点:本题考查酸碱中和滴定。
本题难度:一般
3、选择题 下列说法正确的是( )
A.25℃时NH4Cl溶液的水的离子积常数Kw大于100℃时NaCl溶液的Kw
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O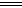 SO32 SO32
参考答案:
本题解析:
本题难度:一般
4、选择题 ①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
A.将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
B.向10mL上述四种溶液中各加入90mL的水后,溶液的pH:③>④>①>②
C.水电离的c(H+):①=②=③=④
D.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
参考答案:C
本题解析:
本题难度:一般
5、选择题 用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.n(OH-)和c(H+)
D.c(H+)和c(OH-)的乘积
参考答案:B
本题解析:加水促进NH3·H2O的电离,使n(NH3·H2O)减小,n(OH-)增大,c(OH-)减小,但c(H+)和c(OH-)的乘积即KW不变,则c(H+)增大。因此c(NH3·H2O)/c(OH-)=n(NH3·H2O)/n(OH-)减小。
本题难度:一般
|