微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某学生在实验室做了5个实验:
(1)在铝盐溶液中逐滴加入稀氨水直至过量,
(2)在明矾溶液中加入NaOH溶液直至过量,
(3)在强碱性溶液中逐滴加入铝盐溶液直至过量,
(4)在偏铝酸钠溶液中通 入CO2直至过量,
(5)在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。
并根据以上实验画出下列5种图象(纵坐标为沉淀物质的量,横坐标为溶液中加入 物质的量)实验与图象对立关系正确的是?
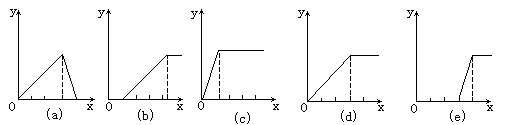
?? [???? ]
A.(1)和(a)
B.(3)和(e)
C.(2)和(b)
D.(4)和(d)
参考答案:B
本题解析:
本题难度:一般
2、填空题 (16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式?????????????????
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是????????????????
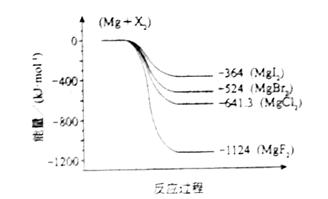
A?? MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B? Mg与X2的反应是放热反应
C? MgBr2与Cl2反应的△H<0
D?化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
①该反应的离子方程式为????????????????????????????????????????????????,平衡常数表达式为???????????????????????????
②在上述平衡体系中加入少量NaCl固体,平衡将?????????(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将?????????,氯气和水反应的平衡常数将?
????????????????(填“变大”、“变小”、“不变”)。
③已知:? H2CO3 ?HCO3- + H+?Ka1(H2CO3) = 4.45×10-7 ??
?HCO3- + H+?Ka1(H2CO3) = 4.45×10-7 ??
HCO3- CO32- + H+??Ka2(H2CO3) = 5.61×10-11
CO32- + H+??Ka2(H2CO3) = 5.61×10-11
HClO  ?H+ + ClO-????Ka(HClO) = 2.95×10-8
?H+ + ClO-????Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
参考答案:(1) 本题解析:(1)氯化镁是由离子键形成的离子化合物,电子式为
本题解析:(1)氯化镁是由离子键形成的离子化合物,电子式为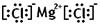 。
。
(2)根据反应过程中的能量变化可知,生成MgF2是放热最多,说明形成的离子键最强,化合物最稳定,所以只有选项D是错误的,答案选ABC。
(3)氯气溶于水生成盐酸和次氯酸,方程式为Cl2+H2O  本题难度:一般
本题难度:一般
3、选择题 在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是(??)
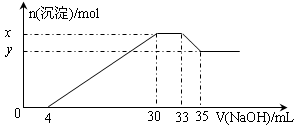
A.原溶液中n(Mg2+)∶n(Al3+)=10∶1
B.原溶液的c(H+)=0.8 mol/L
C.x与y的差值为0.01 mol
D.原溶液中c(Cl-)=0.66mol/L
参考答案:D
本题解析:
试题分析:由图象可知,开始加入氢氧化钠没有沉淀生成,0~4mL发生反应H++OH-=H2O,4mL时H +反应完毕,4~30mL发生反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,30mL时沉淀量最大,Mg2+、Al3+沉淀完全,30~33mL沉淀量不变,发生NH4+与氢氧化钠的反应NH4++OH-=NH3·H2O,33~35mL发生Al(OH)3与氢氧化钠的反应Al(OH)3+OH-=AlO2-+2H2O,0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4m
本题难度:一般
4、选择题 下列溶液能用铝槽车来运送的(??)
A.浓盐酸
B.浓硫酸
C.稀硫酸
D.稀硝酸
参考答案:B
本题解析:铝在常温下能在浓硫酸中发生钝化,所以能用铝槽车来运送浓硫酸,但选项ACD都能和铝发生化学反应,所以不能用铝槽车来运送,答案选B。
本题难度:简单
5、选择题 有一块Al-Fe合金,溶于足量的盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧完全变成红色粉末后,经称量,红色粉末的质量恰好与合金的质量相等,则合金中铝的质量分数为(????)
A.70%
B.30%
C.47.6%
D.52.4%
参考答案:B
本题解析:略
本题难度:简单