微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1mol石墨完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g);△H=+393.5kJ/mol
B.C(s)+
1
2
O2(g)=CO(g);△H=-393.5kJ/mol
C.C+O2=CO2;△H=-393.5kJ/mol
D.C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列热化学方程式或离子方程式中,正确的是[???? ]
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热
19.3kJ,其热化学方程式为: ?△H=-38.6kJ·mol-1 ?△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应: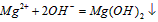
D.氧化铝溶于NaOH溶液:Al2O3 + 2OH- =2AlO2- + H2O
参考答案:D
本题解析:
本题难度:一般
3、填空题 (17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
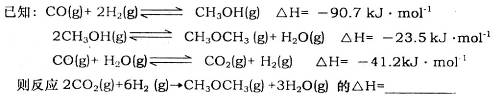
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:

(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1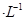 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变) 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1 mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
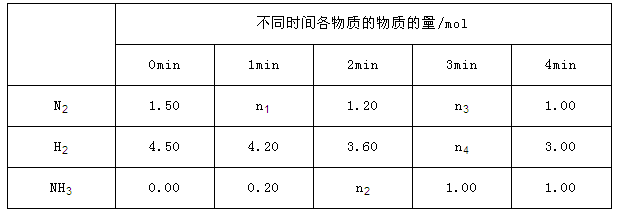
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,
化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol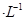 HCOOH和0.1mol HCOOH和0.1mol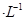 NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。 NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。
该溶液中[HCOOH]-[OH-]+[H+]=______mol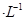
参考答案:(17分)
(1)-122.5kJ·mol-1(2分)
本题解析:
试题分析:(1)根据盖斯定律,将已知热化学方程式中的CO、CH3OH消去,可得所求热化学方程式,所以2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)的△H=(-90.7kJ/mol)×2+(-23.5kJ/mol)-(-41.2kJ/mol)×2=-122.5kJ/mol;(2)根据化学平衡常数的定义,K1=c(CO)2/c(CO2),K2=c(CO2)c(H2)/c(CO)c(H2O),K3="c(CO)"c(H2)/c(H2O),所以K1K2=K3;(3)①二甲醚在负极发生氧化反应,电解质溶液为酸性溶液,所以失去电子生成二氧化碳和氢离子,电极反应式是CH3OCH3-12e-+3H2O=2CO2+12H+;②电解食盐水的化学方程式是2NaCl+2H2O .2NaOH+H2↑+Cl2↑,生成2.24L氢气,物质的量是0.1mol,生成氯气的物质的量应是0.1mol,而溶液中氯离子的物质的量是0.1mol,所以最多生成氯气的物质的量是0.05mol,则产生的氢氧化钠的物质的量是0.1mol,氯离子放电完全后,电解的实质是电解水,所以氢氧根离子的浓度是0.1mol/0.1L=1mol/L,所以溶液的pH=14;(4)①0min~1min内氨气的物质的量增加0.2mol,则氮气的物质的量减少0.1mol,则N2的平均反应速率=0.1mol/2L/1min=0.05mol/(L·min);②该条件下平衡时各物质的浓度是:氨气1.00mol/2L=0.5mol/L,则氮气的浓度是1.5mol/2L-0.5mol/L/2=0.5mol/L,氢气的浓度是氮气的3倍,为1.5mol/L,则反应的平衡常数k=0.52/(0.5×1.53)=0.15;③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,相当于增大压强,平衡正向移动,因为温度不变,则平衡常数不变;(5)0.2mol/L的HCOOH与0.1mol/L的NaOH溶液等体积混合,得到的溶液为0.05mol/L的HCOOH和HCOONa的溶液,因为溶液呈酸性,说明HCOOH的电离程度大于HCOO-的水解程度;根据物料守恒,则2c(Na+)=c(HCOOH)+c(HCOO-)=0.1mol/L,根据电荷守恒,则c(Na+)+c(H+)=c(OH-)+c(HCOO-),两式结合可得c(HCOOH)-c(OH-)+c(H+)=c(OH-)+c(HCOO-)-c(H+)=c(Na+)=0.05mol/L。 .2NaOH+H2↑+Cl2↑,生成2.24L氢气,物质的量是0.1mol,生成氯气的物质的量应是0.1mol,而溶液中氯离子的物质的量是0.1mol,所以最多生成氯气的物质的量是0.05mol,则产生的氢氧化钠的物质的量是0.1mol,氯离子放电完全后,电解的实质是电解水,所以氢氧根离子的浓度是0.1mol/0.1L=1mol/L,所以溶液的pH=14;(4)①0min~1min内氨气的物质的量增加0.2mol,则氮气的物质的量减少0.1mol,则N2的平均反应速率=0.1mol/2L/1min=0.05mol/(L·min);②该条件下平衡时各物质的浓度是:氨气1.00mol/2L=0.5mol/L,则氮气的浓度是1.5mol/2L-0.5mol/L/2=0.5mol/L,氢气的浓度是氮气的3倍,为1.5mol/L,则反应的平衡常数k=0.52/(0.5×1.53)=0.15;③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,相当于增大压强,平衡正向移动,因为温度不变,则平衡常数不变;(5)0.2mol/L的HCOOH与0.1mol/L的NaOH溶液等体积混合,得到的溶液为0.05mol/L的HCOOH和HCOONa的溶液,因为溶液呈酸性,说明HCOOH的电离程度大于HCOO-的水解程度;根据物料守恒,则2c(Na+)=c(HCOOH)+c(HCOO-)=0.1mol/L,根据电荷守恒,则c(Na+)+c(H+)=c(OH-)+c(HCOO-),两式结合可得c(HCOOH)-c(OH-)+c(H+)=c(OH-)+c(HCOO-)-c(H+)=c(Na+)=0.05mol/L。
考点:盖斯定律的应用,平衡常数的计算,溶液pH的计算,电化学反应原理的应用,离子浓度的比较
本题难度:困难
4、填空题 短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素
| 结构及性质
| A
| A的原子半径最小
| X
| X原子最外层电子数是次外层的两倍
| D
| D是短周期中金属性最强的元素
| E
| E的最高价氧化物对应水化物是一种常见的两性氢氧化物
| R
| R与X同主族
| T
| T的负一价阴离子的核外电子排布与Ar原子相同
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
参考答案:(1)第三周期Ⅳ族(1分) 离子键(1分)
本题解析:
试题分析:A的原子半径最小,则A为H元素;X原子最外层电子数是次外层的两倍,则X为C元素;D是短周期中金属性最强的元素,则D为Na元素;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al元素;R与X同主族,则R为Si元素;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl元素。
(1)R为Si元素,在元素周期表中位于第三周期Ⅳ族;化合物DT为NaCl,含有离子键。
(2)E为Al,与NaOH溶液反应的离子方程式为:2Al+2OH?+2H2O = 2AlO2-+3H2↑
(3)X2A4 为C2H4,1g C2H4完全燃烧,恢复到常温时放出a kJ的热量,则1mol C2H4即28g完全燃烧,恢复到常温时放出28a kJ的热量,可得热化学方程式:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1
(4)RT4为SiCl4,水解生成的两种酸为H2SiO3和HCl,或H4SiO4和HCl,所以水解方程式为:SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 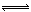 H4SiO4↓+4HCl↑) H4SiO4↓+4HCl↑)
(5)该酸的pH=4,则该酸电离出的H+浓度为10-4mol?L?1,设该酸的物质的量浓度为C,根据电离平衡常数可得:Ka =10-4×10-4÷(c-10-4)= 4.0×10-8,解得c=0.25mol?L?1
考点:本题考查元素的推断、方程式的书写、化学键的判断、电离平衡常数的计算。
本题难度:困难
5、选择题 1 g氢气燃烧生成液态水时放出142.9 kJ热量,表示该反应的热化学方程式正确的是[???? ]
A.2H2(g)+O2(g)===2H2O(l) ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C.2H2+O2===2H2O ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ·mol-1
参考答案:B
本题解析:
本题难度:简单
|
|