微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)某研究性小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设]
假设1:Fe2+的还原性比I-强
假设2:I-的还原性比Fe2+强
假设1:一样强
[验证假设]
(1)设计如下几种装置进行实验:
实验必须的装置是A→_______________(按Cl2气流方向的顺序填写)
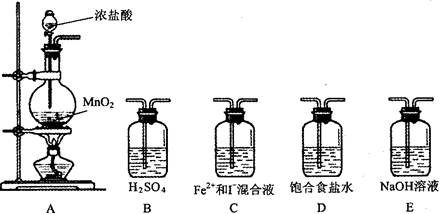
(2)实验开始后,控制通入少量Cl2,通过观察混合溶液颜色的变化_________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论:
实验步骤
| 预期现象和结论
|
取少量反应后的混合溶液分置于A、B两试管中;
往A中滴加__________溶液
往B中滴加__________溶液
| ①若_______________________________
________________________,则假设1成立
②若____________________________
________________________,则假设2成立
③若______________________________
______________________,则假设3成立
(4)为了实验成功,必须控制各物质的用量。该小组称取1.52 g FeSO4,同时称取1.66g KI固体,溶于水中。为了验证上述假设,通入的Cl2体积最多不能超过__________L(标准状况)。[相对分子质量:FeSO4 :152??? KI :166 ]
[思考与交流]
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-的还原性强弱。于是提出另一方案:往KI溶液中滴入__________溶液,如果能发生反应,即可证明和I-的还原性强于Fe2+。该反应的离子方程式为:____________________
2、填空题 MnO2一种黑色粉末,既可用于实验室制O2的催化剂,又可以用于实验室制Cl2.某化学实验小组通过实验来探究一黑色粉末是否由MnO2、FeO组成(不含有其它黑色物质).探究过程如下:
提出假设:假设1.黑色粉末是MnO2;假设2.黑色粉末是FeO;假设3.______.
设计探究实验:
取少量粉末放入足量的稀硫酸中,充分反应后.
(1)若假设1成立,则实验现象是______.
(2)若黑色粉末全部溶解,所得溶液显______,则假设______成立.
(3)若产生______的现象,则假设3成立.
有另一小组同学提出,若混合物中FeO含量很少,可能加入足量的稀硫酸后实验现象不明显,就无法假设3是否成立.
(4)为探究假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氯水,再加入KSCN试剂,若产生______现象,则假设3成立.
3、选择题 从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是(????????)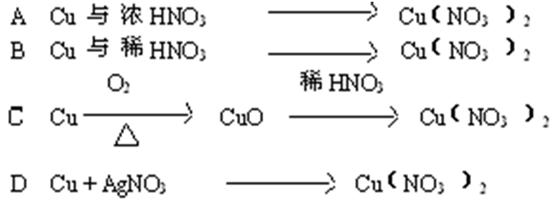
4、计算题 现有表面覆盖铁锈的铁块58.16 g,与足量稀H2SO4反应,可放出22.4 L(标准状况下)H2。反应后溶液中加入KSCN溶液不显红色。求原铁块被氧化的铁的质量。
5、计算题 铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s)?△H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g)?△H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H=???kJ·mol-1。
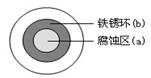
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是??区(填“正极”或“负极”),其电极反应式为???。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③???。
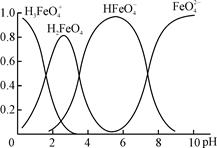
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是???。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为???。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁????g。
|