微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,反应A2(g)+B2(g)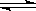 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.单位时间生成 n 摩尔的A2同时生成 n 摩尔的AB
B.容器内的总压不随时间变化
C.单位时间生成 2n 摩尔的AB同时生成 n 摩尔的B2
D.单位时间生成 n 摩尔的A2同时生成 n 摩尔的B2
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。A中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不正确。反应前后气体体积不变,所以压强始终不变,B不正确。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。D中反应速率的方向相同,不正确。答案选C。
本题难度:简单
2、计算题 将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)  2SO3(g)??测得平衡时混合物总的物质的量为5mol,求:
2SO3(g)??测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
参考答案:(10分)
解:设平衡时SO2转化的物质的量为2a
本题解析:
试题分析:解:设平衡时SO2转化的物质的量为2a
2SO2(g)??+?? O2(g)? ???????2SO3(g)
???????2SO3(g)
起始??? 4 mol???????? 2 mol???????????? 0
转化???? 2a??????????? a?????????????? 2a
平衡??4-2a????????? 2-a???????????? 2a
4-2a+2-a+2a=5
a=1???
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol???? n(O2)="1" mol???? n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L???? c(O2)=0.25mol/L???? c(SO3)="0.5" mol/L??
平衡时SO2的转化率="2" mol /4 mol×100%=50%???
点评:本题考查了三行式的应用;对于化学平衡的计算常用此法,学生要多加练习,此类问题便不难解决。
本题难度:一般
3、选择题 在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 [???? ]
A.0.02 mol/(L·min)
B.1.8mol/(L·min)
C.1.2 mol/(L·min)
D.0.18 mol/(L·min)
参考答案:C
本题解析:
本题难度:简单
4、填空题 恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气)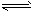 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为___________mol。
(2)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则
x=______mol,y=_______mol。平衡时,B的物质的量__________(选填一个编号)
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2mol
(3)若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是__________。
若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较正确的是
__________ (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
参考答案:(1)3a
(2)2;3-3a;丁
(3)
本题解析:
本题难度:一般
5、填空题 光气(COCl2)在塑料等工业中有许多用途,COCl2的分解反应为:COCl2(g)  ?Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
?Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
①比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2)???T(8)
②比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率
[分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
③比较第14min时,使平衡移动采取措施可以是???????????????????
④比较第8 min和第16min时,平衡常数K值(分别用K8,K16表示)大小关系是???
⑤COCl2在达平衡时的转化率中最大的是第??????????min(范围)
⑥计算出第4min之后再达平衡的混合气体中,平均相对分子质量最大数值是??????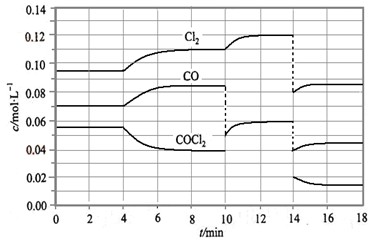
参考答案:①T(2)<T(8)???????????????②v(2~
本题解析::此题中挡题。但不易得分,这主要体现在计算麻烦上。
①根据平衡常数K的计算公式可求出T(2)时的K值很明显小于T(8)时的K值。由于正反应是吸热反应,所以升高温度平衡向正反应方向进行,因此T(2)<T(8)。
②因为5~6分钟时,CO浓度再改变,所以平均反应速率大于其它的。因为反应处于平衡状态,根据反应速率的的计算公式可知,2~3、12~13时的平均反应速率为均为0。
③反应在第14min时,物质的浓度同时突然减小,然后反应物的浓度又逐渐减小,而生成物的浓度逐渐再增大,这么说改变的条件是容器容积变大即体系压强减小。
④由于在K8和K16时,温度是相同的,所以K8时的平衡常数等于K16时的平衡常数。
⑤由于反应达到平衡之后,改变条件时,平衡始终是向正反应方向进行的,所以转化率最大的应该是16min以后。
⑥根据图像可知,第4min之后再达平衡的混合气体中氯气、CO、光气的浓度分别是0.11mol/L、0.085mol/L和0.04mol/L。假设容器容积是1L,则混合气的平均相对分子质量是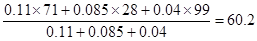
本题难度:一般