微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 分人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+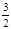 O2(g)? △H="+765.0kJ" /mol。
O2(g)? △H="+765.0kJ" /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。

Ⅱ.目前工业合成氨的原理是:N2(g)+ 3H2(g) 2NH3(g)? △H=-93.0kJ /mol。
2NH3(g)? △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
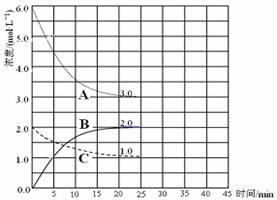
① 表示N2的浓度变化的曲线是??????????????(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是????????????。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ???????(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、 “减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
参考答案: 本题解析:
本题解析:
试题分析:Ⅰ.催化剂可以降低反应的活化能,加快反应速率,但不能改变反应热,据此可以作图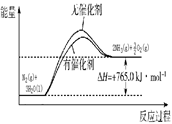 或
或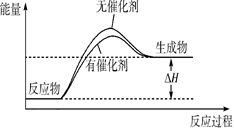 。
。
Ⅱ.(1)根据盖斯定律可知,(②-①)÷3即得到H2(g)+1/2O2(g) H2O(l),所以该反应的反应热是△H=(-93.0kJ /mol-765.0kJ /mol)÷3=-286.0 kJ /mol,所以氢气的燃烧热是△H=-286.0 kJ /mol。
H2O(l),所以该反应的反应热是△H=(-93.0kJ /mol-765.0kJ /mol)÷3=-286.0 kJ /mol,所以氢气的燃烧热是△H=-286.0 kJ /mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项c可以说明。该反应是体积减小的可逆反应,所以当压强不再发生变化时,可以说明,a正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确。D中反应速率的方向是相同的,不正确。速率之比是相应的化学计量数之比,因此e中的关系始终是成立,不正确,因此答案选ac。
(3)①根据图像可知,反应进行到25min时物质的浓度不再发生变化,此时ABC的浓度变化量分别是(mol/L)A减少3.0,B增加2.0,C减少1.0,所以表示N2的浓度变化的曲线是C,表示H2的浓度变化的曲线是A,表示氨气的浓度变化的曲线是B。
②前25 min 内,用H2的浓度变化表示的化学反应平均速率是3.0mol/L÷25min=0.12 mol·L-1·min-1。
③根据平衡常数的表达式可知,该反应的K=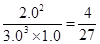 。由于正方应是放热反应,所以若升高温度,平衡向逆反应方向移动,该反应的平衡常数值将减小。
。由于正方应是放热反应,所以若升高温度,平衡向逆反应方向移动,该反应的平衡常数值将减小。
(4)升高温度,反应速率增大,但平衡向逆反应方向移动,所以根据氢气的浓度变化量可知,平衡时氨气的浓度应该是1.0mol/L,所以该图应该是(见答案)。
(5)①???????? N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始量(mol)?? 1????? 3????????? 0
转化量(mol)?? x????? 3x???????? 2x
平衡量(mol) 1-x?? 3-3x??????? 2x
则1-x+3-3x+2x=2.8
解得x=0.6
所以氢气的转化率是60%。
②α1 + α2 =1,所以氨气的转化率是40%,则
N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始量(mol)?? 0????? 0????????? y
转化量(mol)?? 0.2y? 0.6y????? 0.4y
平衡量(mol)?? 0.2y? 0.6y????? y-0.4y
则0.2y+0.6y+y-0.4y=2.8
解得y=2
点评:该题以化学反应速率和化学平衡为载体,重点考查学生灵活运用基础知识解决实际问题的能力。试题综合性强,贴近高考,易于激发学生的学习兴趣和学习求知欲。有利于培养学生的逻辑推理能力和应试能力,提高学生的规范答题能力和学习效率。
本题难度:困难
2、选择题 对于处于化学平衡状态的反应CO(g)+H2O(g)??CO2(g)+H2(g)?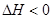 ,若要提高CO的转化率,下列措施中可行的是?????????????(???)
,若要提高CO的转化率,下列措施中可行的是?????????????(???)
A.升温
B.增大H2O(g)的浓度
C.增大压强
D.使用合适的催化剂
参考答案:B
本题解析:A错,该反应的正反应方向为放热反应,升温,平衡向逆反应方向移动,CO的转化率减小;B正确;C错,该反应为等体积反应,改变压强,平衡不移动;D错,催化剂不能影响平衡的移动;
本题难度:一般
3、选择题 反应3A(g)+B(g)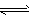 2C(g)+2D(g)在不同条件下,反应速率分别为
2C(g)+2D(g)在不同条件下,反应速率分别为
①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·s-1
④v(D)=0.45 mol·L-1·min-1
则此反应在不同条件下进行得最快的是
[???? ]
A.②③
B.①③
C.②④
D.①
参考答案:A
本题解析:
本题难度:简单
4、填空题 甲烷在高温下分解:2CH4(气)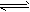 3H2(气)+C2H2(气)。达到平衡时,容器内压强为原来的1.5倍,此时三种物质的物质的量之比为_______________。
3H2(气)+C2H2(气)。达到平衡时,容器内压强为原来的1.5倍,此时三种物质的物质的量之比为_______________。
参考答案:n(CH4)∶n(H2)∶n(C2H2)=2∶3∶1
本题解析:
本题难度:一般
5、选择题 右图表示反应2X(g) Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
化曲线:下列说法正确的是
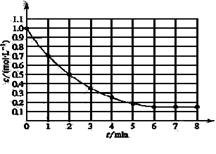
A.2min时X的平均转化率为50%
B.第6min后,反应就停止了
C.若升高温度,X的平衡转化率将减小
D.若减小压强,v正和v逆将以同样倍数减小
参考答案:A
本题解析:根据图像可知,2mion时X的浓度是0.5mol/L,所以X的浓度变化量是1.0mol/L-0.5mol/L-0.5mol/L,因此X的转化率是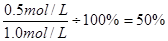 。6min后各种物质的浓度不再发生变化,说明反应达到了平衡状态,反应速率不等于0,反应并没有停止。正反应是吸热反应,所以升高温度平衡向正反应方向移动,X的转化率增大。因为反应前后体积是增大,所以降低压强,正逆反应均减小,但减小的倍数是逆反应速率大于正反应速率,所以平衡向正反应方向移动。答案选A。
。6min后各种物质的浓度不再发生变化,说明反应达到了平衡状态,反应速率不等于0,反应并没有停止。正反应是吸热反应,所以升高温度平衡向正反应方向移动,X的转化率增大。因为反应前后体积是增大,所以降低压强,正逆反应均减小,但减小的倍数是逆反应速率大于正反应速率,所以平衡向正反应方向移动。答案选A。
本题难度:一般