微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)甲醇是一种可再生能源,具有广泛的开发和应用前景。请回答:
(1)工业上合成甲醇CO(g) + 2H2(g)? ??CH3OH(g)? ΔH,在不同温度下的化学平衡常数(K)如表所示。
??CH3OH(g)? ΔH,在不同温度下的化学平衡常数(K)如表所示。
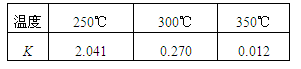
①根据表中数据可判断ΔH??????(填“>” 或 “=” 或 “<”)0。?????
②300℃时,向容积为1L的密闭容器中充入2 mol CO、3 mol H2和2 mol CH3OH,此时反应将???????????????。
A.向正方向移动???????B.向逆方向移动???????C.处于平衡状态??
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l)?? ΔH= -a? kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g)??ΔH= -b kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
???????????????????????????????????????????????????????。
(3)改变下列条件,能同时加快正反应的速率,增大CO的转化率的是?????????
A.使用催化剂????????????B.缩小容器体积
C.降低温度??????????????D.分离CH3OH的物质的量
(4)以甲醇、氧气为原料,KOH溶液作为电解质溶液构成燃料电池总反应为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,则负极的电极反应式为?????????????????。
2、选择题 下列事实中,不能用勒夏特列原理解释的是(???)
A.NO2、N2O4平衡混合气体加热后颜色变深
B.氯水长期露置于空气中褪色
C.弱电解质的溶液达到平衡后,加水稀释,平衡向电离的方向移动
D.合成氨工业,采用铁触媒催化剂
3、选择题 已知一定条件下,N2(g)和H2(g)反应生成2molNH3(g)放出92.4kJ热量。在同温同压下,向两个相同的容积可变的密闭容器中分别通入1molN2、4molH2和0.5molN2、2molH2,在同温同压条件下达到平衡,分别放出热量Q1kJ和Q2kJ,则下列关系正确的是[???? ]
A.2Q2 = Q1 = 92.4
B.2Q2 < Q1 < 92.4
C.2Q2 = Q1 < 92.4
D.Q2 = Q1 < 92.4 ?
4、选择题 下列四组实验中现象或结论不正确的是
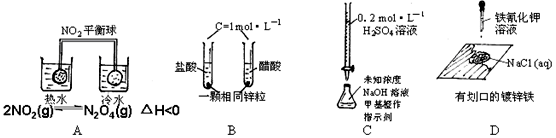
序号
| 实验现象
| 结??论
|
A
| 热水中平衡球颜色比冷水中深
| 升温,化学平衡向吸热反应方向移动
|
B
| 起始时产生气泡速率HCl > CH3COOH
| 醋酸是弱电解质
|
C
| 溶液颜色由黄变橙,且30秒内不变色
| 已达滴定终点
|
D
| 划口处有蓝色沉淀
| 铁发生了析氢腐蚀
5、选择题 某温度下碳和水蒸气在密闭容器中发生下列反应:C + H2O(g) CO(g) + H2(g) CO(g) + H2(g)
CO(g) + H2O(g) CO2(g) + H2(g)?当反应达平衡时测得c(H2) ="1.9" mol/L,c(CO) =" 0.1" mol/L。则CO2的浓度为 CO2(g) + H2(g)?当反应达平衡时测得c(H2) ="1.9" mol/L,c(CO) =" 0.1" mol/L。则CO2的浓度为
A.0.1 mol/L
B.0.9 mol/L
C.1.8 mol/L
D.1.9 mol/L
|