微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列表述正确的是
A.pH=3的CH3COOH溶液的浓度小于pH=2的盐酸的浓度
B.向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大
C.将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+)
参考答案:C
本题解析:
试题分析:A、醋酸为弱酸,电离微弱,pH=3的CH3COOH溶液的浓度大于pH=2的盐酸的浓度,错误;B、向NaHCO3溶液中加入少量NaOH固体,二者反应生成碳酸钠和水使c(HCO3-)减小,错误;C、根据电荷守恒知,将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),正确;D、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),错误。
考点:考查弱电解质的电离和盐类的水解。
本题难度:一般
2、选择题 在一定条件下发生下列反应,其中属于盐类水解反应的是( ? )
A.NH4++2H2O?NH3?H2O+H3O+
B.HCO3-+H2O?H3O++CO32-
C.HS-+H+═H2S
D.Cl2+H2O?H++Cl-+HClO
参考答案:A
本题解析:
本题难度:简单
3、填空题 (10分)某海域海水一些化学成分如下表
海水成分
| Na+
| Ca2+
| Mg2+
| HCO3-
| Zn2+
|
含量/mol·L-1
| 0.4
| 0.002
| 0.045
| 0.002
| 10-7
已知:25℃时,Ksp(CaCO3)=2.8×10-9、Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.8×10-11。
某化学小组同学欲在实验制备MgCl2,并提取Zn。设计流程如下:
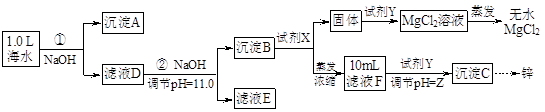
[假设①②过程溶液体积不变,忽略分离过程的损失]
(1)25℃时测得海水的pH为8.0,其原因是(写离子方程式) 。
(2)下图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图。
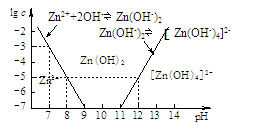
请结合图中数据回答:
试剂X的化学式为 ;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH的范围为 。
(3)同学们发现,把MgCl2溶液蒸发、灼烧所得的白色固体难溶解于水,于是认为其主要成分是MgO。你认为 (填“正确”、“不正确”),原因是(用化学方程式表示) 、 。
(4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp= 。
参考答案:(1)HCO3-+H2O?H2CO3+OH-
(2)N
本题解析:
试题分析:(1)海水中的成分是弱酸的酸式酸根离子,水解使溶液呈碱性:HCO3-+H2O?H2CO3+OH-;(2)海水在①加入NaOH使转化为碳酸根离子与钙离子反应产生沉淀A碳酸钙,滤液D继续加入NaOH至PH=11.0,产生沉淀B,成分为氢氧化锌和氢氧化镁,沉淀B继续加入NaOH将氢氧化锌溶解,而氢氧化镁不溶,从而分离,根据浓度对数一PH图表可知:由滤液F到沉淀C过程,将锌离子转化为氢氧化锌沉淀的PH范围为9-11,一般认为离子浓度低于10-5mol/L就是沉淀完全,由c(Zn2+)=10-5mol/L,lgc=-5,PH=8,c([ Zn(OH-)4]2-)=10-5mol/L,lgc=-5,PH=12,故应调节的pH的范围为8-12;(3)MgCl2是强酸弱碱盐,水解MgCl2+2H2O?Mg(OH)2+2HCl,加热使水解程度增大而产生氢氧化镁,同时产生的盐酸易挥发使平衡正向移动,最终产生的氢氧化镁沉淀灼烧分解产生氧化镁和水,涉及的反应为:MgCl2+2H2O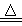 Mg(OH)2↓+2HCl↑、Mg(OH)2 Mg(OH)2↓+2HCl↑、Mg(OH)2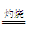 MgO+H2O;(4)由图表可知,当lgc=-5时,c(Zn2+)=10-5mol/L,PH=8,c(OH-)=10-6mol/L,Ksp[Zn(OH)2]= c(Zn2+) [c(OH-)]2=10-5mol/L ×(10-6mol/L)2 =10-17mol3·L-3。 MgO+H2O;(4)由图表可知,当lgc=-5时,c(Zn2+)=10-5mol/L,PH=8,c(OH-)=10-6mol/L,Ksp[Zn(OH)2]= c(Zn2+) [c(OH-)]2=10-5mol/L ×(10-6mol/L)2 =10-17mol3·L-3。
考点:考查。
本题难度:困难
4、选择题 氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,下列叙述的原因中正确的是( )
A.NH4+水解生成NH3·H2O和HD2O+
B.NH4+水解生成NH3·DHO和HD2O+
C.NH4+水解生成NH3·D2O和HD2O+
D.NH4+水解生成NH3·DHO和D3O+
参考答案:D
本题解析:氯化铵是强酸弱碱盐,NH4+水解显酸性。水解的实质是NH4+结合水电离出的OH-生成一水合氨,在重水中则结合OD-生成NH3·DHO。在重水中氢离子是以D3O+形式存在。所以正确的答案是D。
本题难度:困难
5、选择题 在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列物质的溶液,可以得到该固体物质的是( )
A.氯化铝
B.碳酸氢钠
C.硫酸镁
D.高锰酸钾
参考答案:C
本题解析:AlCl3溶液加热蒸干并灼烧后得到Al2O3,因为AlCl3水解时生成HCl,盐酸为挥发性酸,在加热时挥发除去,将得到固体Al(OH)3,然后灼烧Al(OH)3分解,得到Al2O3。而碳酸氢钠和高锰酸钾在加热蒸干并灼烧过程中会发生分解反应。
本题难度:一般
|