微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g) 2NH3(g)? ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g)? ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
| 丙
|
反应物投入量
| 1molN2、3molH2
| 2molNH3
| 4molNH3
|
NH3的浓度(mol/L)
| c1
| c2
| c3
|
反应的能量变化
| 放出a kJ
| 吸收b kJ
| 吸收c kJ
|
体系压强
| P1
| P2
| P3
|
反应物转化率
| α1
| α2
| α3
?
下列说法正确的是
A.2 c1>c3?????? B.a + b=92.4????????C.2P1<P3??????D.α1 +α3=1
参考答案:B
本题解析:
试题分析:A、丙可以看作是两个甲容器平衡后再放入同一个容器中,若平衡不移动,则有2 c1=c3,但是放入同一个容器中后,平衡正向移动,导致2 c1<c3,错误;B、从二个方向开始的反应达到平衡时,应该有a + b=92.4,正确;C、因为是同温同体积的条件,所以压强比等于物质的量的比,丙的情况可以理解为两个甲分别达到平衡后再充在一个容器中,假如平衡不移动,则压强正好是二倍,但是随着压强的增大,平衡正向移动,导致物质的量减少,所以有2P1>P3错误;D、在反应容器甲中,反应物是氮气和氢气,在反应容器乙中,反应物是氨气,达到平衡时有α1 +α2=1,但对于丙容器来讲,相当于乙中的反应物的二倍,转化是降低的,也就是说α2>α3,因此有α1 +α3<1,错误。
本题难度:一般
2、选择题 氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数(???)
A.5.4×10—5
B.4.5×10—4
C.0.015
D.无法计算
参考答案:B
本题解析:
试题分析:在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;依据平衡三段式列式计算得到平衡浓度: Cl2+H2O?H++Cl-+HClO
起始浓度:0.09??? 0??? 0???? 0
转化浓度:0.03?? 0.03? 0.03? 0.03
平衡浓度:0.06?? 0.03? 0.03? 0.03
K=c(H+)c(Cl?)c(HClO) c(Cl2) ="0.03×0.03×0.03" 0.06 =4.5×10-4
本题难度:一般
3、填空题 (5分)在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l) 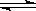 ?4NH3(g)+3O2(g) △H =" a" kJ.mol-1 ?4NH3(g)+3O2(g) △H =" a" kJ.mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
温度T/K
| 303
| 313
| 323
| NH3生成量/(10—6mol)
| 4.8
| 5.9
| 6.0
①该反应的a______0(填“>”、“<”或“=”)(2分)
②已知:N2(g)+3H2( g) g) 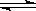 3NH3(g) △H =" —92.4" kJ.mol-1 3NH3(g) △H =" —92.4" kJ.mol-1
2H2(g) + O2(g)==2H2O(l)?△H =" —571.6" kJ.mol-1
则 2N2(g) + 6H2O(l) 2N2(g) + 6H2O(l) 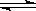 ?4NH3(g) + 3O2(g)△H = _________。(3分) ?4NH3(g) + 3O2(g)△H = _________。(3分)
参考答案:①>?②1530.0 kJ.mol-1
本题解析:略
本题难度:一般
4、选择题 在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2 N2O4,分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是[???? ] N2O4,分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是[???? ]
A.平均反应速率A>B
B.平衡时NO2的物质的量B>A
C.平衡时NO2的转化率A>B
D.平衡时N2O4的物质的量B>A
参考答案:D
本题解析:
本题难度:一般
5、填空题 (14分)金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。?

已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼???烧”所需主要仪器有?????????????????。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 ???????? 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O?未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为?????????(用小数表示,保留二位小数)。
参考答案:(14分)(1)FeTiO3+2H2SO4===FeSO4+
本题解析:
试题分析:(1)钛铁矿主要成分为钛酸亚铁(FeTiO3),酸溶后得TiO2+和Fe2+,所以步骤①化学反应方程式为:FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O;因为一部分铁元素在钛铁矿处理过程中会转化为+3价,所以加入铁粉目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,冷却、结晶将物质分离,是利用了物质的溶解性的不同,所以答案选b;
(3)步骤②、③、④中都是固、液分离,所以涉及到的操作是过滤;步骤⑤“灼烧”所需主要仪器有坩埚、酒精灯、三脚架、泥三角;
(4)步骤④溶液中存在平衡:TiO2+ + 3H2O 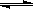 Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。 Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
(5)废液中含有未结晶的Fe2+,与二氧化锰发生氧化还原反应,生成Fe3+、Mn2+,离子方程式为MnO2 + 2Fe2+ + 4H+ ="==" Mn2+ + 2Fe3+ + 2H2O?;
(6)根据得失电子守恒规律,n(FeSO4·7H2O)=5n(KMnO4),250mL的溶液中n(FeSO4·7H2O)=19.00×10-3L×0.01mol/L×10×5=9.5×10-3mol,所以绿矾样品中FeSO4·7H2O的质量分数为9.5×10-3mol×278g/mol÷2.85g=0.93。
本题难度:一般
|
|