微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列解释实验现象的反应或离子方程式不正确的是
A.金属Al放入NaOH?溶液中产生大量气泡:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将盛有二氧化氮气体的试管倒立在水中,气体变为无色,有液体进入试管:3NO2+H2O=2HNO3+NO
C.淀粉KI溶液与H2SO4酸化的H2O2溶液混合,溶液变蓝:2I-+H2O2+2H+=2H2O+I2
D.溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+H2O
参考答案:D
本题解析:分析:A.Al与NaOH溶液反应生成偏铝酸钠和氢气;
B.二氧化氮与水反应生成硝酸与NO;
C.发生氧化还原反应生成水和碘;
D.溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,反应生成硫酸钡沉淀、偏铝酸钾、水.
解答:A.Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故A正确;
B.二氧化氮与水反应生成硝酸与NO,化学反应为3NO2+H2O=2HNO3+NO,故B正确;
C.发生氧化还原反应生成水和碘,发生的离子反应为2I-+H2O2+2H+=2H2O+I2,故C正确;
D.溶质物质的量之比为1:2的明矾溶液与Ba(OH)2溶液混合,反应生成硫酸钡沉淀、偏铝酸钾、水,离子反应为
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故D错误;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应及离子反应方程式的书写方法即可解答,题目难度不大,注意明矾为KAl(SO4)2.12H2O.
本题难度:一般
2、选择题 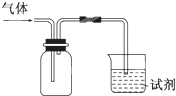 下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A、二氧化硫使高锰酸钾溶液,体现的是二氧化硫的还原性;
B、二氧化硫使品红褪色,体现二氧化硫的漂白性;
C、二氧化硫与氢氧化钠能反应,但无明显现象;
D、因为二氧化硫的漂白有一定的选择性,不能漂白石蕊等,结论有酸性,但不能因此说没有漂白性.
解答:A、酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子,是酸性高锰酸钾的氧化性的体现,这里体现的是二氧化硫的还原性,故A错误;
B、使品红溶液褪色是特征反应,化合生成不稳定的化合物加热后又恢复为原来的红色,体现了二氧化硫的漂白性,故B正确;
C、二氧化硫为酸性氧化物,能跟氢氧化钠反应生成亚硫酸钠和水,但无明显现象,故C错误;
D、二氧化硫使紫色石蕊试液变红后不褪色,结论有酸性,但不能因此说没有漂白性,因为二氧化硫的漂白有一定的选择性,不能漂白石蕊等,故D错误;
故选B.
点评:本题考查二氧化硫的性质,二氧化硫为酸性氧化物,具有酸性氧化物的通性,二氧化硫还具有漂白性、强还原性的弱氧化性,二氧化硫的漂白具有选择性.
本题难度:一般
3、选择题 以下的说法正确的是
A.通式为CnH2n+2的有机物一定属于烷烃
B.通式为CnH2n的有机物一定属于烯烃
C.通式为CnH2n-2的有机物一定属于炔烃
D.通式为CnH2n-6(n≥6)的有机物一定属于芳香烃
参考答案:A
本题解析:
本题难度:困难
4、选择题 市场上销售的“84”消毒液的有效成份是
A.Cl2
B.NaClO
C.SO2
D.KMnO4
参考答案:B
本题解析:分析:市场上销售的“84”消毒液的有效成份是NaClO,据此解答.
解答:84消毒液是一种以次氯酸钠为主的高效消毒剂,主要成分为次氯酸钠(NaClO),故选B.
点评:本题考查次氯酸盐的性质与用途,比较基础,注意对基础知识的识记.
本题难度:一般
5、选择题 在500毫升1mol/LFeCl3溶液中加入铁粉,完全反应后,除去多余的铁粉,加入足量的NaOH溶液,搅拌充分反应,所得沉淀的物质的量是
A.0.5mol
B.1mol
C.0.75mol
D.不能确定
参考答案:C
本题解析:分析:根据铁和三氯化铁的反应计算生成氯化亚铁的量,根据氯化亚铁和氢氧化钠的反应FeCl2+2NaOH=Fe(OH)2↓+2NaCl以及反应4Fe(OH)2+2H2O+O2=4Fe(OH)3来计算最后生成的沉淀的量.
解答:500毫升1mol/LFeCl3溶液中,Fe3+的物质的量是0.5L×1mol/L=0.5mol,根据反应,设生成的亚铁离子物质的量为n,则
2Fe3++Fe=3Fe2+
2 3
0.5mol?? n

解得n=0.75mol,根据氯化亚铁和氢氧化钠的反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,所以0.75mol的氯化亚铁和氢氧化钠的反应生成沉淀0.75mol,Fe(OH)2会迅速被氧化,即4Fe(OH)2+2H2O+O2=4Fe(OH)3,所以0.75mol的Fe(OH)2会生成0.75mol的Fe(OH)3.
故选C.
点评:本题考查学生金属铁以及化合物的性质,可以根据所学知识进行回答,难度较大.
本题难度:困难