微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) [???? ]
A.阳极发生还原反应,其电极反应式:Ni2++2e-== Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
参考答案:D
本题解析:
本题难度:一般
2、填空题 (9分)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。
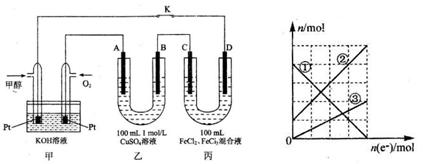
Ⅰ.工作一段时间后,断开K,此时 C电极质量减少3.2g。
(1)甲中负极的电极反应式为
(2)乙溶液此时离子浓度由大到小的顺序是
Ⅱ.连接K,继续电解一段时间,当A,B两极上产生的气体体积相同时
(3)乙中A极析出的气体在标准状况下的体积为 ,溶质的物质的量浓度为 mol/L (不考虑溶液体积变化)
(4)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是 离子的变化;此时要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5. 0 moL/L NaOH 溶液。
参考答案:共10分
(1)CH3OH-6e-+8OH-=CO32
本题解析:
试题分析:(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O。
(2)电解前乙溶液含CuSO4物质的量为:0.1L×1mol?L?1=0.1mol,C电极质量减少3.2g,发生的反应为Cu—2e?=Cu2+,n(e?)=2n(cu)=2×3.2g÷64g/mol=0.1mol,电解乙溶液发生的反应为:2CuSO4+2H2O 2Cu+2H2SO4+O2↑,则消耗Cu2+为0.05mol,剩余Cu2+发生水解反应,生成的H+为0.1mol,Cu2+发生水解反应可生成少量的H+,故乙溶液此时离子浓度由大到小的顺序是:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
2Cu+2H2SO4+O2↑,则消耗Cu2+为0.05mol,剩余Cu2+发生水解反应,生成的H+为0.1mol,Cu2+发生水解反应可生成少量的H+,故乙溶液此时离子浓度由大到小的顺序是:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
(3)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2+ + 2e- = Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
x x
得到0.2+2x=4x,则x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L;最终生成的H+为:0.4mol-0.2mol=0.2mol,则H2SO4的浓度为:1/2×0.2mol÷0.1L=1mol?L?1。
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,图中②线表示的是Fe2+的变化,依据(2)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为:1.4mol÷5mol/L=0.28L=280ml。
考点:本题考查原电池原理、电解原理、离子浓度比较、化学计算。
本题难度:困难
3、选择题 某学生欲完成2HCl+2Ag==2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是[???? ]
A.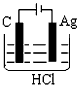
B.
C.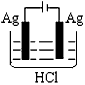
D.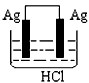
参考答案:C
本题解析:
本题难度:简单
4、选择题 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)
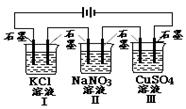
A.13、7、1
B.12、7、2
C.1、7、13
D.7、13、1
参考答案:A
本题解析:
试题分析:Ⅲ中阴极析出单质铜,Cu2++2e=Cu,0.32gCu的物质的量为0.005mol,该电极放电0.01mol,I中用惰性电极电解KCl溶液,电解总反应为2KCl+2H2O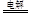 2KOH+H2↑+Cl2↑转移电子2e-,生成KOH 0.01mol,c(OH-)=0.01mol/0.1L=0.1mol/L,溶液的PH=13,Ⅱ中NaNO3溶液属于强酸强碱盐,溶液的PH=7,Ⅲ中用惰性电极电解CuSO4溶液,电解总反应为2CuSO4 +2H2O
2KOH+H2↑+Cl2↑转移电子2e-,生成KOH 0.01mol,c(OH-)=0.01mol/0.1L=0.1mol/L,溶液的PH=13,Ⅱ中NaNO3溶液属于强酸强碱盐,溶液的PH=7,Ⅲ中用惰性电极电解CuSO4溶液,电解总反应为2CuSO4 +2H2O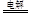 2Cu+2H2SO4 +O2↑,转移电子4e-,生成H2SO4 0.005mol,c(H+)=0.01mol/0.1L=0.1mol/L,溶液的PH=1,选A。
2Cu+2H2SO4 +O2↑,转移电子4e-,生成H2SO4 0.005mol,c(H+)=0.01mol/0.1L=0.1mol/L,溶液的PH=1,选A。
考点:考查电解的工作原理及PH值的计算。
本题难度:一般
5、选择题 1 L K2SO4和CuSO4的混合溶液中c(S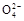 )="2.0" mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为(??)
)="2.0" mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为(??)
A.2.0 mol·L-1
B.1.5 mol·L-1
C.1.0 mol·L-1
D.0.5 mol·L-1
参考答案:A
本题解析:依题意,阳极反应:4OH--4e-=O2↑+2H2O;阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑。则生成22.4 L O2、H2分别转移4 mol e-、2 mol e-,根据得失电子守恒,Cu2+转移2 mol e-,则n(Cu2+)="1" mol,c(Cu2+)=" 1" mol·L-1,根据电荷守恒:c(K+)+2c(Cu2+)=2c(S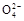
本题难度:一般