微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列属于加成反应的是
A.甲烷燃烧
B.在FeBr3催化下,苯与液溴反应生成溴苯
C.光照条件下甲烷与氯气反应生成一氯甲烷
D.乙烯使溴水褪色
参考答案:D
本题解析:有机物分子中双键或三键两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应。A属于氧化反应,B和C是取代反应,所以答案选D。
本题难度:一般
2、选择题 下列实验现象的描述错误的是(??)
A.氢气在氯气中燃烧生成绿色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.向铜丝在氯气中燃烧后的集气瓶加入少量的水,所得溶液显绿色
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
参考答案:A
本题解析:考查常见的化学实验现象。氢气在氯气中燃烧发出的是苍白色火焰,如果点燃注入发生爆炸,所以选项A不正确,其余都是正确的,答案选A。
本题难度:一般
3、实验题 (14分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉: a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质
| SiCl4
| AlCl3
| FeCl3
| PCl5
|
沸点/℃
| 57.7
| —
| 315
| —
|
熔点/℃
| -70.0
| —
| —
| —
|
升华温度/℃
| —
| 180
| 300
| 162
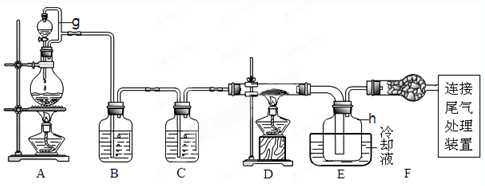
请回答下列问题:
(1)写出装置A中发生反应的离子方程式????????????????????????????来源:91考试网????。
(2)装置A中g管的作用是??????????????????;装置C中的试剂是?????????????;装置E中的h瓶需要冷却理由是?????????????????。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:?????????????????????????????????????;
②滴定前是否要滴加指示剂?????????(填“是”或“否”),判断滴定终点的方法是??????????????????????????????????????????????????????????。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是??????????????。若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响??????????(填“偏高”、“偏低”、或“无影响”)
参考答案:(1)MnO2+4H++2Cl- 本题解析:(1)装置A是制取氯气的,所以发生反应的离子方程式是 本题解析:(1)装置A是制取氯气的,所以发生反应的离子方程式是
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。 Mn2++Cl2↑+2H2O。
(2)要使分液漏斗中的液体顺利滴下,所以作用是平衡压强,使液体顺利滴下;应用四氯化硅遇水极易水解,所以在通入装置D之前需要,需要干燥处理,即装置C中的试剂是浓硫酸;SiCl4的熔点较低,所以作用是使SiCl4冷凝。
(3)①酸性高锰酸钾溶液就有强氧化性,能把亚铁离子氧化生成铁离子,反应的方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
②由于酸性高锰酸钾溶液,在溶液中显紫红色,所以不需要另加指示剂。因此终点时的现象是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色。
③根据反应式可知,25.00ml溶液中亚铁离子的物质的量是0.0200L×0.01mol/L×5=0.001mol,所以残留物中铁元素的质量分数是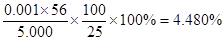 ;若滴定前平视,滴定后俯视KMnO4液面,则消耗高锰酸钾溶液的体积减少,则测定结果偏低。 ;若滴定前平视,滴定后俯视KMnO4液面,则消耗高锰酸钾溶液的体积减少,则测定结果偏低。
本题难度:一般
4、选择题 常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如图。下列说法正确的是
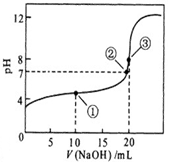
A. 点①所示溶液中:c(A-)+c(OH-) =c(HA) +c(H+)
B. 点②所示溶液中:c(Na+) = c(HA) +c(A-)
C. 点③所示溶液中:c(Na+) > c(A-)> c(OH-) > c(H+)
D. 滴定过程中可能出现:c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
参考答案:C
本题解析:
本题主要考查的是粒子浓度大小的比较。A项,处于点①时,酸过量,根据电荷守恒,则有c(H+)=c(OH-)+c(A-);B项,在点②时,pH=7,仍没有完全反应,算过量,c(Na+)<c(A-)+c(HA);C项,当V(NaOH)=20.00ml时,两者完全反应,此时由于HA-的水解,溶液呈碱性,但水解程度是微弱的,c(Na+)>c(A-)>c(OH-)>c(H+),正确;D项,在滴定过程中,当NaOH的量少时,不能完全中和醋酸,则有c(HA) > c(A-) > c(H+) > c(Na)> c(OH-)+)?,故D错误。 综上分析可知,本题选C项。
本题难度:一般
5、选择题 利用下图装置做下面的实验:在烧杯里盛半杯乙溶液,?然后用滴定管向容器里滴入甲溶液。随着甲的滴入电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入甲溶液,电灯又会逐渐亮起来。下列各组溶液中(甲在前,乙在后),能够产生上述现象的是

A.NH3·H2O、HNO3
B.CH3COOH、NH3·H2O
C.NaOH、HCl
D.H2SO4、Ba(OH)2
参考答案:D
本题解析:略
本题难度:简单
|