微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
① Fe+Cu2+===Fe2++Cu ② Ba2++2OH-+2H++SO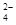 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③ Cl2+H2O===H++Cl-+HClO ④ CO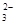 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤ Ag++Cl-===AgCl↓
A.只有③
B.②③
C.③⑤
D.①④
参考答案:A
本题解析:
试题分析:③的离子反应中反应物均为分子(Cl2、H2O),只能代表一个反应即Cl2+H2O===HCl+HClO。
考点:考查离子反应。
本题难度:一般
2、填空题 (共8分)A、B、C、D、E均为可溶于水的固体,组成他们的离子有
阳离子
| Na+ Mg2+ Al3+ Ba2+
|
阴离子
| OH- Cl- CO32- SO42- HSO4-
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A ;B ;C ;D ;E 。
(2)写出④中反应的离子方程式: 。
(3)A溶液中各种离子浓度由大到小的顺序为 。
参考答案:(1)Na2CO3、Al2(SO4)3、MgCl2、Ba(O
本题解析:
试题分析:阴离子CO32-只能和Na+结合为Na2CO3;OH-能和Ba2+结合为溶于水的Ba(OH)2,则SO42-和Al3+结合成的物质为Al2(SO4)3;最后剩余Cl-和HSO4-结合的阳离子Na+、Mg2+;由题干可知A和B、C、D都生成沉淀且沉淀都溶于酸溶液,所以A为Na2CO3;E中含HSO4-,沉淀可以是Mg2+、Al3+、Ba2+的碳酸盐沉淀;B、C、D物质中分别含这三种阳离子,由④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3,可推出B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4) 2),(1)综上所述,A为Na2CO3,B为Al2(SO4)3,C为MgCl2,D为Ba(OH)2,E为NaHSO4[或Mg(HSO4)2];(2)④中反应的离子方程式为2Al3++3SO42- +3Ba2+ +8OH-=== 3BaSO4↓+2AlO2- +4H2O;(3)A为碳酸钠,碳酸根离子水解显碱性,第一步水解大于第二步水解,则离子浓度大小为c( Na+)> c(CO32-)>c( OH-) >c(HCO3-)>c( H+)。
考点:考查无机物的推断。
本题难度:困难
3、填空题 (4分)写出下列反应的离子方程式:氢氧化钡溶液和硫酸溶液反应
铁与硫酸铜溶液反应
参考答案:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2
本题解析:
试题分析:稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,该离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O; 铁与硫酸铜溶液反应化学方程式Fe+CuSO4=Cu+FeSO4;硫酸亚铁和硫酸铜都是易溶于水的盐,反应离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+Cu2+=Fe2++Cu;
考点:离子方程式的书写
本题难度:一般
4、选择题 下列离子方程式正确的是( )
A.氢氧化镁中滴加盐酸:H++OH-==H2O
B.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-==BaSO4↓+H2O
C.已知电离平衡常数:H2CO3>HClO>HCO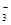 ,向次氯酸钠溶液中通入少量二氧化碳的离子方程式为: ,向次氯酸钠溶液中通入少量二氧化碳的离子方程式为:
2ClO-+CO2+H2O==2HClO+CO32-
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO 完全沉淀: 完全沉淀:
NH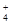 +Al3++2SO +Al3++2SO +2Ba2++4OH-==Al(OH)3↓+NH3·H2O+2BaSO4↓ +2Ba2++4OH-==Al(OH)3↓+NH3·H2O+2BaSO4↓
参考答案:D
本题解析:
试题分析:A.氢氧化镁难溶于水,应该写化学式,错误;B.反应的离子不能部分约减,在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O,错误;C.根据复分解反应的规律:强酸与弱酸的盐发生复分解反应制取弱酸,所以反应ClO-+CO2+H2O==HClO+HCO3-,错误;D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO 完全沉淀时二者的物质的量的比是1:2,离子方程式是: NH 完全沉淀时二者的物质的量的比是1:2,离子方程式是: NH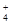 +Al3++2SO +Al3++2SO +2Ba2++4OH-==Al(OH)3↓+NH3·H2O+2BaSO4↓,正确。 +2Ba2++4OH-==Al(OH)3↓+NH3·H2O+2BaSO4↓,正确。
考点:考查离子方程式书写的正误判断的知识。
本题难度:困难
5、选择题 向100mL0.1mol·L
参考答案:
本题解析:
本题难度:一般
|