微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
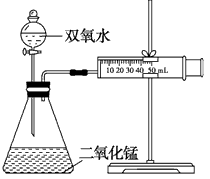 ??
?? 
分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择.
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________ 理由是____________ 。
参考答案:(1)加快
(2)0.3
(3) 不正确
本题解析:
本题难度:一般
2、填空题 已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别
| 温度/℃
| V(H2C2O4)
/mL
| V(KMnO4)
/mL
| V(H2O)
/mL
| KMnO4溶液
褪色时间/s
|
1
| 30
| 10
| 10
| 20
| 40
|
2
| 30
| 20
| 20
| 0
| t
|
3
| 30
|
|
| 15
|
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
参考答案:(10分)(1)H2C2O4 本题解析: 本题解析:
试题分析:(1)草酸(H2C2O4)是一种二元弱酸,电离方程式为H2C2O4 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。 H++ HC2O4—;(2)①根据化合价升降法及元素守恒配平离子方程式为2MnO4-+5H2C2O4+6H+ ==2Mn2++10CO2↑+8H2O ;②溶液突然褪色,说明反应速率突然增大,原因最有可能是催化剂,答案选C;(3)①变量控制,总体积为40ml,加水15ml,与实验1比较,可得答案;②反应不是均速进行,由于生成物有催化作用,无法确定褪色时间,答案选D。
考点:草酸的性质、电离、氧化还原反应、化学反应速率
本题难度:困难
3、选择题 为了进一步研究硫酸铜的量对氢气生成速率的影响,某同学设计了如表一系列实验。将表中所给的试剂按一定体积混合后,分别加入四个盛有过量Zn粒的反应瓶(甲、乙、丙、丁)中,收集产生的气体,记录收集相同体积的气体所需时间。
实验
试剂/mL
| 甲
| 乙
| 丙
| 丁
| 4 mol/L H2SO4
| 20
| V1
| V2
| V3
| 饱和CuSO4溶液
| 0
| 2.5
| V4
| 10
| H2O
| V5
| V6
| 8
| 0
下列说法正确的是 ( )
A.实验甲产生气泡的速率最快 B.V1<V2<V3<20
C.V4=V5=10 D.V6=7.5
参考答案:D
本题解析:加入硫酸铜主要通过反应形成Zn|H2SO4(aq)|Cu原电池,从而使反应速率加快,A错误;根据信息可知,只考虑硫酸铜的量,而不考虑硫酸的浓度,所以应使每组实验最终溶液中硫酸的浓度一致,为了实验的简单化,可取同量的硫酸,而硫酸铜和水的体积之和相同,即V1=V2=V3=20,B项错误;由丁组知硫酸铜和水的体积之和为10 mL,所以V4=2、V5=10,C错误;V6=7.5,D正确。
本题难度:一般
4、填空题 (1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI Ⅱ.2HI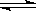 H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)=
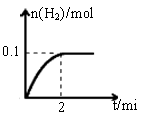
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
参考答案:(1)(每小题3分,共6分)
3CH3COOH+CH2
本题解析:(1)甘油中含有3个羟基,所以和乙酸发生酯化 反应,消耗3分子乙酸。蔗糖是二糖,水解生成葡萄糖和果糖。2-丙醇中和羟基相连的碳原子上只有1个氢原子,催化氧化的产物是丙酮。
(2)根据图像可知,平衡时氢气的物质的量是0.1mol,所以消耗碘化氢是0.2mol,因此其反应速率是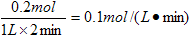 。 。
(3)考查外界条件对反应速率的影响。浓硝酸和浓硫酸都是氧化性酸,和锌反应生成物不是氢气。b和c中可以构成原电池,反应速率可以加快。温度升高,反应速率加快。e是增大反应物的接触面积,反应速率加快。所以答案选af。
本题难度:一般
5、选择题 设C + CO2 2CO 2CO 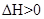 的反应速率为 的反应速率为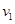 ,N2 + 3H2 ,N2 + 3H2 2NH3 2NH3
参考答案:
本题解析:
本题难度:简单
|
|