微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有如下各说法:
①仅含共价键的物质就是共价化合物
②所有化学反应都要经历旧化学键断裂和新化学键形成
③离子键的实质是阴、阳离子间的静电引力
④化学反应过程一定伴随着能量变化
⑤H2和Cl2的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述五个说法中,正确的有:
A.1个
B.2个
C.3个
D.4个
参考答案:B
本题解析:①错误,氢气等单质分子。③不正确,应该是静电作用。⑤不正确,形成的化学键是共价化合物。所以正确的答案是B。
本题难度:简单
2、选择题 下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤对电子,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
参考答案:B
本题解析:
试题分析:配位化合物中必定存在配位键,A正确;B不正确,在配位化合物中还含有其他化学键;C中水中的氧原子含有孤对电子,铜离子含有空轨道,可以形成配位健,C正确,D也水正确的,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对配位健以及配位化合物的了解掌握情况,有利于培养学生的学习兴趣,调动学生的学习兴趣,提高学生的学习效率和应试能力。
本题难度:一般
3、选择题 下列叙述正确的是(?????)
A.越难失电子的元素得电子能力一定越强
B.溶于水可以导电的化合物一定是离子化合物
C.第三周期元素的最高正化合价等于它所处的主族序数
D.离子化合物中可以含有共价键,共价化合物可以含有离子键
参考答案:C
本题解析:
试题分析:越难失电子的元素得电子能力不一定越强,例如稀有气体元素,A不正确;溶于水可以导电的化合物不一定是离子化合物,例如氯化氢是共价化合物,B不正确;离子化合物中可以含有共价键,共价化合物不可能含义离子键,答案选C。
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和检验的同时,侧重对学生能力的培养。该题的关键是学会通过举例逐一排除筛选得出正确结论的方法,有利于调动学生的学习兴趣,提高学生的应试能力。
本题难度:一般
4、实验题 100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
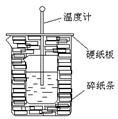
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是 。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案) KJ/mol。
参考答案:(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)不相
本题解析:考查中和热的测定。实验中需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)实验过程中需要尽可能的减少热量损失,所以碎纸条的作用是减少实验过程中的热量损失。
(3)由于反应中生成的水不同,所以放出的热量不同。但中和热是不变的,因为中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量。
(4)氨水中存在电离平衡,电离吸热,所以测定结果偏小。
(5)根据题意反应中放出的热量是4.03×6.7×200×1.02+6.7×46.1=5817.074J=5.82kJ
所以反应热是-5.82kJ÷0.1mol=-58.2kJ/mol。
本题难度:一般
5、选择题 下列分子的中心原子的杂化类型与其他不同的是
A.SiCl4
B.H2S
C.PCl5
D.NH3
参考答案:C
本题解析:
试题分析:A.SiCl4的中心原子Si采用sp3杂化;B.H2S的中心原子S采用sp3杂化;C. PCl5的中心原子P采用sp3d杂化;D.NH3中的中心原子N采用sp3杂化。所以杂化方式不同的是PCl5。选项为C。
本题难度:简单