微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法或表达正确的是
①次氯酸的电子式为
②含有离子键的化合物都是离子化合物?
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤将金属a与电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀
A.①③⑤
B.①②③
C.②④
D.④⑤
参考答案:C
本题解析:
试题分析:①次氯酸分子中氧原子分别与氢原子、氯原子形成两个公用电子对,错误;②正确;③溶液的导电能力与溶液中自由移动的离子浓度和离子所带电荷数有关,强电解质溶液中离子浓度不一定大,弱电解质溶液中离子浓度也不一定小,错误;④正确;⑤被保护的金属应与电源的负极相连,错误。
本题难度:一般
2、简答题 洋蓟素是一种新型的抗乙型肝炎和艾滋病病毒的化合物,其结构如图所示.请回答下列问题:
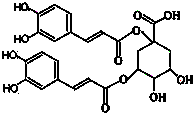
(1)洋蓟素分子中“苯环上的含氧官能团”的名称是______;它的水溶液显______(填:中、酸、碱)性.
(2)有关洋蓟素的说法错误的是______
A.是一种芳香烃
B.可以使酸性KMnO4和溴水褪色
C.能与氯化铁溶液发生显色反应
D.能发生卤代、酯化、硝化和磺化反应
E.?1mol最多可与11molNaOH反应
F.不能与新制Cu(OH)2发生变红色的反应
(3)若洋蓟素在酸性条件下水解,生成2种有机物M(含苯环)和R(不含苯环),则:
①在催化剂作用下,M与足量的H2作用下的加成产物为(写结构简式)______;
邻苯二酚与A物质发生加成反应可生成M,其化学方程式为:

则A物质的结构简式为:______;
②R的分子式为______;如果用R与浓硫酸共热,当只消去环上羧基的间位的2个官能团,并生成对称双键产物的化学反应方程式为______.
参考答案:(1)根据有机物的结构简式可知洋蓟素分子中“苯环上的含氧官能
本题解析:
本题难度:一般
3、选择题 下列化学变化过程中不涉及氧化还原反应的是??????????????????????(???)
A.氯碱工业
B.水玻璃制硅酸
C.工业制硝酸
D.海水中提炼镁
参考答案:B
本题解析:略
本题难度:简单
4、填空题 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
废液
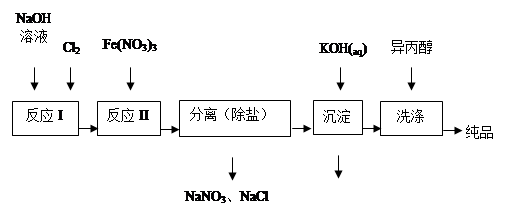 ①洗涤粗品时选用异丙醇而不用水的理由是: 。 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法
| 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
| 干法
| Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
参考答案:(共15分,除(1)③3分外其它每空2分)
(1)①减
本题解析:
试题分析:
(1)①钾盐易溶于水,用有机溶剂可以避免钾盐的损失
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠、和水。
③上一步反应生成了次氯酸根,作为唯一的氧化剂氧化三价铁离子生成氯离子和高铁酸盐。
④Ksp〔Fe(OH)3〕=c3(OH-)·c(Fe3+)算出,c(OH-)=10-11,根据pH的算法,pH=3.
(2)①Ksp〔K2FeO4〕=c2(K+)·c(FeO42-),故增加钾离子浓度可以析出K2FeO4晶体。
②否则就用同样类似的方法制备Na2FeO4了。
(3)N得到2个电子,Fe 得到3个电子,所以N*3,Fe *2,又因为是Fe2O3(重点是Fe2),故比例为3:1.
考点:考查氧化还原反应,以及非金属单质及其化合物,化学反应原理等。
本题难度:困难
5、选择题 在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
A.氧化产物与还原产物的物质的量之比为2∶5
B.氧化产物与还原产物的物质的量之比为5∶2
C.氧化剂与还原剂的物质的量之比为1∶8
D.氧化剂与还原剂的物质的量之比为5∶1
参考答案:B
本题解析:
试题分析:根据方程式可知,Mn元素的化合价从+7价降低到+2价,得到2个电子。氯元素的化合价从-1价升高到0价,失去1个电子。所以根据电子的得失守恒可知,氧化剂与还原剂的物质的量之比为1∶5,氧化产物与还原产物分别是氯气和氯化锰,所以二者的物质的量之比为5∶2,答案选B。
考点:考查氧化还原反应的有关判断和计算
点评:在进行氧化还原反应的计算时,需要利用好电子的得失守恒这一关系式。
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772