微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (17分)氢气和氨气都属于无碳清洁能。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2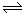 MH2x(s) △H<0(M表示某种合金)
MH2x(s) △H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_____________
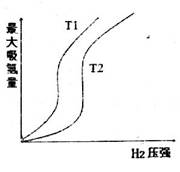
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。
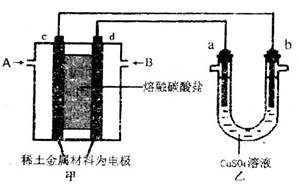
①工作过程中,甲装置中d电极上的电极反应式为_____________________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)十3H2(g) 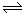 2NH3(g) △H=
2NH3(g) △H= 92.4kJ·mol-1
92.4kJ·mol-1
2H2(g)十O2(g)=2H2O(1) △H= 572KJ·mo1-1
572KJ·mo1-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmotN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)十3H2(g) 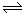 2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为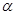 。
。
①该反应的平衡常数K=________,(用含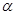 的代数式表示)
的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含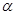 的代数式表示)
的代数式表示)
2、选择题
图甲中电极均为石墨电极,下列叙述中正确的是
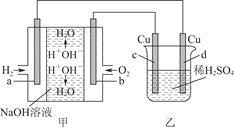
A.电子沿a→d→c→d路径流动
B.b极的电极反应为O2+4e-+4H+=2H2O
C.通电初期乙中的总反应为Cu+H2SO4  CuSO4+H2↑
CuSO4+H2↑
D.反应过程中,甲、乙装置中溶液的pH都逐渐减小
3、选择题 下列装置中能组成原电池形成电流的是(???? )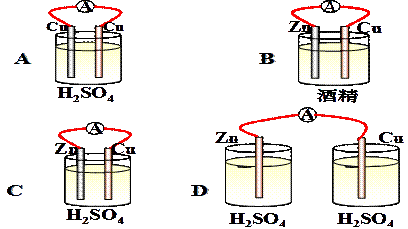
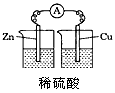
4、选择题 某小组为研究原电池原理,设计如图装置,下列叙述正确的是
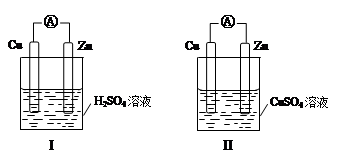
A.装置I,铜片上有O2逸出
B.装置I,锌片溶解,发生还原反应
C.装置II,电池反应为:Zn+ Cu2+= Zn2++ Cu
D.装置II,外电路中,电子从锌电极流向铜电极
5、选择题 下列装置中,明显有电流产生的是
[????? ]
A.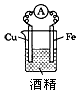
B.
C.
D.