微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (18分)锡是一种银白色而又柔软的金属, 2000年前人类就已开始使用锡。金属锡为排列在白金,黄金及银后面的第四种贵金属,它富有光泽、无毒、不易氧化变色,具有很好的杀菌、净化、保鲜效用。生活中常用于食品保鲜、罐头内层的防腐膜等。请回答下列有关锡的问题:
(1)锡在自然界几乎都以锡石的形式存在,此外还有极少量的锡的硫化物矿。以锡石(SnO2)为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为?????????????????,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为____________。
(2)锡的氯化物有SnCl2和SnCl4。SnCl2是生产和化学实验中常用的还原剂,易发生水解;SnCl4常温下是无色液体,在空气中极易水解,熔点—36℃,沸点114℃。
Ⅰ.若实验室中以SnCl2固体配制SnCl2溶液,试简述操作方法?????。
Ⅱ.某实验小组拟利用下图中的仪器,设计组装一套实验装置,用熔融的金属锡与干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热),已知金属锡的熔点为231℃。请回答下列各问题:
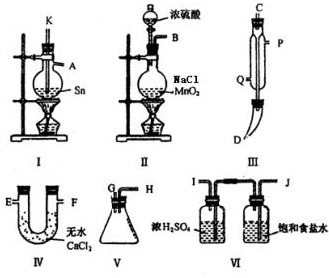
①用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)____接____、____接____、____接____、____接____、____接____。
②装置Ⅵ的作用是___________;装置Ⅳ的作用是___________。
③冷凝管里冷却水的流向是从___________进入,从___________流出。
④试验时点燃Ⅰ处酒精灯,加热温度应大于?????????℃,待???????????????????即可停止加热。
⑤如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是_______________。
⑥该实验装置中还存在的一个问题是?????????????????????????????????。
参考答案:(1)SnO2+C 本题解析:本题插图应该是:
本题解析:本题插图应该是:

(1)焦炭与锡石在高温下发生氧化还原反应生成锡,炭被氧化为CO(高温下碳的低价氧化物稳定),即:SnO2+C Sn+CO
Sn+CO
金属的精炼时,纯锡做阴极,溶液中的锡离子得电子析出:Sn2++2e-="Sn"
(2)Ⅰ.综合题目所给信息,SnCl2易水解、易氧化,故应将SnCl2固体溶解在少量浓盐酸中,抑制其水解,加水稀释后,加金属锡,以防止其氧化:Sn4++Sn=2Sn2+
Ⅱ.①制取四氯化锡首先得制取干燥纯净的氯气,所需装置为II、VI,用饱和食盐水吸收HCl气体,用浓硫酸干燥,气流遵循“长进短出”,接口顺序为B、J;I
装置I为四氯化锡的制取装置,由于反应放大量的热,过量的氯气及气化的四氯化锡混合从运管A口逸出,随后需要冷凝管(装置III)进行冷却,经冷凝的四氯化锡液体收集要装置V中,接口顺序为I、K;A、C;D、G;H
为防止空气中的水蒸气进入装置V中(四氯化锡极易水解,保证其无水环境),H接口后应连接装置IV,其中的CaCl2可阻止空气的水分;
综合可知,接口顺序为B、J;I、K;A、C;D、G;H、E
②装置Ⅵ的作用是除去Cl2中的HCl和水气;装置Ⅳ的作用是防止空气中水蒸气进入收集SnCl4瓶内;
③为保证冷凝水的冷凝效果,应从低口Q进,高口P出,使热气遇到的一直是冷水
④加热温度只需超过金属锡的熔点为231℃即可,由于反应大量放热,待锡粒熔化后即可停止加热
⑤四氯化锡少许暴露于空气,与水水解,生成大量的极易溶于水的HCl气体,形成白雾
⑥由于氯气有毒,而本实验缺少尾气吸收装置,应用盛有NaOH(或碱)溶液的烧杯吸收多余Cl2
本题难度:一般
2、实验题 ( 14分)
(1)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
苯(甲苯)????????;苯(乙醇)????????;甲苯(溴)????????。
(2)实验室由电石中的碳化钙和水反应制取乙炔,该反应的化学方程式 为?????,实验中为了减缓反应速率,常用??????代替水,若实验中产生的气体存在难闻的气味,可以用_________________(填试剂)加以除去。
为?????,实验中为了减缓反应速率,常用??????代替水,若实验中产生的气体存在难闻的气味,可以用_________________(填试剂)加以除去。
(3)某兴趣小组的同学在实验室里制取的乙烯中常混有少量二氧 化硫,他们设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
化硫,他们设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
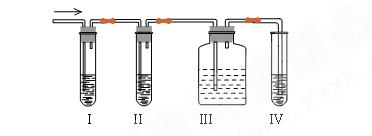
1)I、II、III、IV装置可盛放的试剂依次为??? ????(填字母)
????(填字母)
①品红溶液??②NaOH溶液?③浓硫酸???④酸性KMnO4溶液
A.④②①③
B.①②①③
C.①②①④
D.④②①④
2)能说明SO2气体存在的现象是????。
3)使用装置III的目的是???????????。
4)确定含有乙烯的现象是??????????。
参考答案:( 14分)
(1)高锰酸钾酸性溶液;水; NaOH
本题解析:略
本题难度:一般
3、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
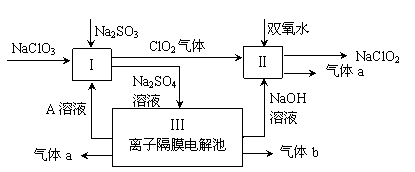
(1)双氧水的结构式为:???????????;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 ?????????????????????? 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 ???????????????????????? 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 ????(填相同、不相同或无法判断)
参考答案:(14分)(1)H-O-0-H?? Na2SO3 (各2分)
本题解析:
试题分析:⑴H2O2中两个氧原子间形成一个共用电子对,结构式为:H―O―O―H,反应I:2ClO3―+SO32―+2H+=2ClO2+SO42―+H2O,其中SO32―中S由+4价变成+6价,作还原剂,格答案为:H―O―O―H;Na2SO3 ;⑵从图中读出反应物为ClO2和H2O2,碱性条件,产物为NaClO2,ClO2作氧化剂,H2O2中氧由―1价变成―2,2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O,故答案:2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;⑶Ⅲ阳极:2H2O―4e―=4H+ +O2↑,a为O2,阴极:4H2O+4e―=4OH―?+2H2↑,?b为H2, A的化学式是H2SO4, 装置Ⅲ中A在阳极区产生,答案:H2SO4、阳;⑷Cl―浓度大时,还原性增强,被生成的ClO2氧化,5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O。答案为:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O;⑸ClO2―、ClO3―与Fe2+ 反应最终都变成Cl―,变质前后转移的电子数相同,反以消耗Fe2+的物质的量相同。答案:相同。
本题难度:简单
4、实验题 15分)某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物。且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃。

⑴关闭活塞a、接通竖直冷凝管的冷凝水,给A加热30分钟,制备。仪器E的作用是????????????。
⑵上述反应的副产物可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、SO2、水等。
①打开活塞a,在竖直冷凝管上方塞上塞子,通过B、C、D装置检验SO2和乙烯。已知C中盛放的试剂是NaOH溶液,B、D中应盛放的试剂依次分别是????????????????????????。
②有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”,来确定副产物中存在乙醚。请你对该同学的观点进行评价:???????????????????????????????。
⑶通过下列实验方案,可以提纯苯甲酸乙酯。
①为除去产品中杂质,先将三口烧瓶中残液倒入盛有冷水的烧杯中,并加入?????????。
②用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是???????????????。
③向锥形瓶中加入适量豆粒大小的无水氯化钙干燥剂,至醚层澄清透明;过滤得醚层,然后将醚层加入到干燥的蒸馏烧瓶中蒸馏,蒸馏过程中控制的温度为????????。
参考答案:⑴冷凝回流(或导气兼冷凝))?⑵①品红、溴水(或酸性KMnO
本题解析:(1)由于反应中的有机试剂在加热过程中易挥发,为提高产率,冷凝管除导气作用外主要是冷凝回流。
(2)①乙烯检验一般通过溴水褪色或酸性高锰酸钾溶液褪色,SO2的检验一般用品红试剂,而SO2也可使溴水褪色或酸性高锰酸钾溶液褪色,故需要先检验SO2,再用碱液吸收,再检验乙烯
(3)提纯苯甲酸乙酯,可用碱液或饱和Na2CO3溶液除去酸性水溶性物质,再用进行分液,最后再对有机层进行蒸馏分离即可。
本题难度:一般
5、选择题 用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是
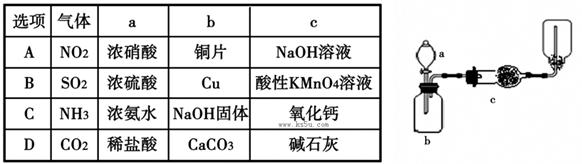
参考答案:C
本题解析:
试题分析:由实验装置图可知,该装置为液体与固体(或液体)在不加热条件下反应制备气体的装置,并且气体密度比空气小,用向下排空法收集,再进一步考虑题中要制备气体的净化是否合理。方法一、由装置图知该气体用向下排空法收集,说明其密度比空气小,结合选项只有氨气的密度比空气小,选C。方法二、逐项分析:A、NO2与NaOH反应而被吸收,不能用NaOH溶液净化,净化装置为干燥管只能盛放固体试剂,NO2密度比空气大,不能用向下排空气法收集,错误;B、浓硫酸与金属铜的反应需在加热的条件下进行,而本实验没有加热,SO2与酸性KMnO4溶液反应而被吸收,不能用酸性KMnO4溶液净化,净化装置为干燥管只能盛放固体试剂,SO2密度比空气大,不能用向下排空气法收集,错误;C、氨气密度比空气小,能用向下排空法收集,氨气可用固体干燥剂干燥,正确;D、二氧化碳能与碱石灰反应,不能用碱石灰净化,并且二氧化碳密度大于空气,不能用向下排空法收集,错误。
本题难度:一般