微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (20分)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4?500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为?????????????????????
(2)如果实验室有15mL、20mL、50mL量筒,应选用??????????????mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将?????????(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的????????????里,并不断搅拌,目的是????????????????????????????。
(4)将??????????????的上述溶液沿???????????注入???????????????中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要?????????????????????中,并摇匀。
(5)加水至距刻度?????????????????????处,改用??????????????????加水,使溶液的凹液面正好跟刻度相平。
参考答案:.14ml;15ml;偏低;烧杯;防止浓硫酸飞溅;冷却后;玻
本题解析:考查一定物质的量浓度的配制。
(1)根据稀释过程中溶质不变可知,0.5×0.5=1.84V×98%÷98,解得V=14ml即浓硫酸的体积是14ml。
(2)规格越接近,误差越小,所以应该选择15ml的量筒。水洗后直接量取,相当于稀释,浓度偏低。
(3)由于浓硫酸的密度大于水的,且溶于水放出大量的热,所以浓硫酸的稀释应该在烧杯中完成,且需要不断的搅拌,以防止浓硫酸飞溅。
(4)转移之前,需要冷却,转移时用玻璃棒引流,注入500ml容量瓶中。烧杯和玻璃棒都需要洗涤,且洗涤液要注入容量瓶中。
(5)当接近刻度线1~2cm时,用胶头滴管加水定容。
本题难度:一般
2、选择题 下列实验方案合理的是(?)???
A.向溴乙烷中滴加硝酸银溶液和稀硝酸时,有淡黄色沉淀产生
B.配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液
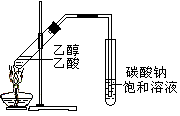
C.制备乙酸乙酯:用右图所示的实验装置
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
参考答案:D
本题解析:
试题分析:溴乙烷和硝酸银溶液不反应,A不正确;B不正确,应该是在一定量NaOH溶液中,加入少量CuSO4溶液;C不正确,导管口不能插入溶液中,以防止倒吸。D中环己烯能和溴的四氯化碳溶液发生加成反应,苯和溴的四氯化碳溶液发生萃取,可以鉴别,选项D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练。有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:简单
3、实验题 氮及其化合物在生产、生活中有重要的作用。
(1)NH3是制碱工业中不可缺少的重要物质。继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,其工艺流程如下:
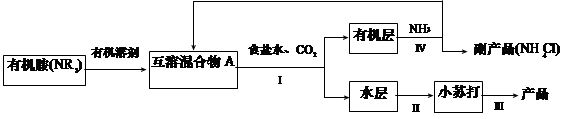
已知:NR3 + CO2 + NaCl + H2O = NaHCO3 + NR3·HCl
NR3 + HCl = NR3·HCl,且NR3·HCl 易溶于有机溶剂。
①操作Ⅰ名称为?????????????????;
②某实验小组同学查阅资料知,有机溶剂和有机胺沸点差别较大,现欲将A中各成分进行分离,请写出除了导管、酒精灯、牛角管、锥形瓶外,该分离操作所需的玻璃仪器名称 ????????????????????;
(2)N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):
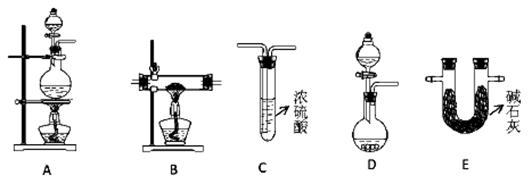
①某化学兴趣小组甲同学欲用加热NaNO2 和NH4Cl的浓溶液制得N2,应该选择的发生装置是????????,检验该发生装置气密性的操作为 ?????????????????????????????????????????????;
②在加热条件下,用NH3 还原CuO可制得N2,同时获得铜粉,此反应的化学方应方程式是?????????????????????????????????。乙同学用此法制得干燥、纯净的N2,且需要的NH3 以生石灰和浓氨水作原料。按气流从左到右,整套装置的连接顺序是????????????????(填写字母序号);最后一个装置中试剂的作用是?????????????????????????????????;
参考答案:(1)①分液(2分)
②蒸馏烧瓶、温度计、冷凝管(2分
本题解析:
试题分析:(1)①分离互补相溶液体的方法是分液,所以操作Ⅰ名称为分液。
②有机溶剂和有机胺沸点差别较大,可用蒸馏分离,根据蒸馏的仪器:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶,因此还缺少蒸馏烧瓶、温度计、冷凝管。
(2)①根据已知信息可知,反应物是亚硝酸钠(NaNO2)和氯化铵的浓溶液混合加热制备氮气,所以需要圆底烧瓶作反应容器,同时还需要加热,因此A装置适合;检验装置气密性的方法一般是利用压强差来进行,所以正确操作是安装好仪器后,关闭分液漏斗下端活塞并将导管连接长导管后置于水中,用酒精灯微热圆底烧瓶,若导管口有气泡冒出。撤掉酒精灯后导管内有一段水柱,则装置气密性好;反之,则装置气密性不好。
②根据原子守恒可知,NH3与CuO反应生成N2、铜和水,所以反应的化学方程式为3CuO+ 2NH3 N2+ 3Cu + 3H2O;需要的NH3 以生石灰和浓氨水作原料,因此需要用D用来制取氨气,氨气是碱性气体,不能用浓硫酸干燥,应该用E装置(碱石灰)干燥氨气。在B中反应后,剩余的氨气可用C装置来除去,同时C装置中的浓硫酸还能干燥氮气。所以按气流从左到右,整套装置的连接顺序是DEBC。
N2+ 3Cu + 3H2O;需要的NH3 以生石灰和浓氨水作原料,因此需要用D用来制取氨气,氨气是碱性气体,不能用浓硫酸干燥,应该用E装置(碱石灰)干燥氨气。在B中反应后,剩余的氨气可用C装置来除去,同时C装置中的浓硫酸还能干燥氮气。所以按气流从左到右,整套装置的连接顺序是DEBC。
本题难度:一般
4、实验题 (14分)某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaC l2+2H2SO4
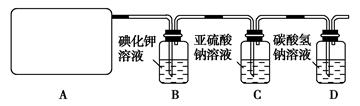
l2+2H2SO4 2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
试回答:
(1)该实验中A部分的装置是________(填写装置的序号);
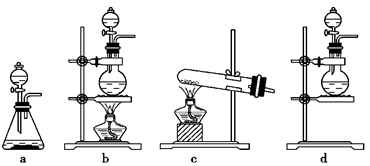
(2)B中反应的化学方程式是?????????????????????????????。
(3)写出C中反应的离子方程式??????????????????????,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_ ________________????????????????????????????????????????。
________________????????????????????????????????????????。
(4)写出在D装置中发生反应的离子方程式????????????????????????????。
(5)该实验存在明显的缺陷是__________________________________。
(6)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL。则该漂白粉中Ca(ClO)2的质量分数为___??????_____。
参考答案:(每空2分,共14分)
(1)b?(2)Cl2+2KI
本题解析:略
本题难度:简单
5、实验题 (8分)用18.4mol/L的浓硫酸配制lmol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取???????mL浓硫酸?????????
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸倒入100 mL容量瓶中?????
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
⑴第步操作中应用量筒量取???????mL浓硫酸;应选择??????mL量筒(填5、10或50)
⑵本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器?是???????????、??????????、??????????????。(可以不填写满)
⑶正确的操作顺序是(用序号填写)????????????????????????????????????????????。
⑷定容时,如果俯视刻度线,配制的硫酸浓度将偏 ????????(填大或小)
参考答案:(8分)(1)5.4mL;? 10?(各1分)?????(2
本题解析:略
本题难度:一般