本题解析:
试题分析:(1)由于浓硫酸溶于水会放出大量的热量,且密度大于水的,所以在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先加入乙醇后缓慢注入硫酸,不断搅拌,冷却后加醋酸。
(2)乙酸乙酯生成的化学方程式是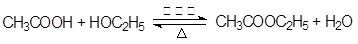 。
。
(3)由于生成的乙酸乙酯中混有乙酸和乙醇,所以饱和碳酸钠溶液的作用是反应乙酸、溶解乙醇、降低乙酸乙酯溶解度,利于酯的分层析出,且便于闻到乙酸乙酯的香味。
(4)由于乙酸和乙醇都是和水互溶的,所以导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中的目是防止倒吸。
(5)由于实验需要加热,所以做此实验时,向盛乙酸和乙醇的试管里加入几块碎瓷片的目的是防止暴沸。
点评:该题是高考中的常见考点,属于中等难度的试题。试题难易适中,侧重对学生基础性知识的巩固与训练,有助于培养学生综合实验能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题的难点是平衡状态的判断。
本题难度:一般
2、简答题 溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
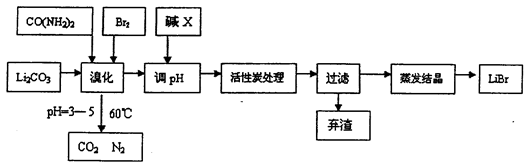
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
参考答案:(1)二氧化碳 (1分)逆反应方向(1分) 温度过高会加快溴
本题解析:
试题分析:(1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2,另一方面使溴单质和水的反应Br2+H2O H++Br-+HBrO平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃。
H++Br-+HBrO平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃。
(2) BrO-发生了自身的氧化还原反应是Br元素化合价升高和降低:3BrO- BrO3- +2 Br-。
BrO3- +2 Br-。
(3)调节pH溶液时不增加新杂质,阳离子是Li+,故碱是LiOH;活性炭用于吸附脱色。
(4)题干信息“氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气”,不难写出3 Br2+3 Li2CO3+2 NH3.H2O="6" LiBr+5 H2O+N2↑+3 CO2↑。
(5) 用惰性电极电解熔融碳酸锂可得到金属锂,阳极阴离子CO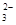 ?放电,电极方程式为2 CO
?放电,电极方程式为2 CO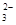 -4 e-=O2↑+2CO2↑。
-4 e-=O2↑+2CO2↑。
(6) 若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率。
本题难度:一般
3、填空题 用如图所示装置可以收集以下几种气体(烧瓶位置不动)(填字母,下同);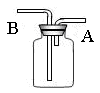
①H2?②SO2?③CH4④ HCl ⑤ NH3???⑥ NO??⑦H2S
(1)若烧瓶是干燥的,则由A口进气,可收集到的气体有??????????,由B口进气,可收集的气体有??????????。
(2)若在烧瓶中充满水,可收集的气体有??????????,气体由??????????口进入。
(3)若此装置用于净化气体,在烧瓶内装有洗涤液,则混合气体应由??????????口进入。
参考答案:(1)①③⑤;②④⑦???(2)①③⑥? A?(3)B
本题解析:
试题分析:(1)关键装置图可知,若烧瓶是干燥的,由A口进气收集气体,这说明该气体的密度小于空气的,因此符合条件的是氢气、甲烷和氨气,答案选①③⑤;由B口进气收集气体,这说明该气体的密度大于空气的,因此符合条件的是SO2、氯化氢和H2S,NO极易被氧化,不能用排空气法收集,答案选②④⑦。
(2)若在烧瓶中充满水,收集气体,说明气体不溶于水,和水与不反应,则符合条件氢气、甲烷和NO,则答案选①③⑥,此时气体由A口进入。
(3)当烧瓶中装入洗液,用于洗气时,要使洗气更充分,则气体应从B口进入烧瓶。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题针对性强,注重答题的灵活性,有利于培养学生的实验能力和实验分析和评价能力。注意收集气体时常根据气体的密度、溶解性等性质,有时还要考虑与氧气的反应等问题,如NO与氧气反应,则只能用排水法收集。
点评:
本题难度:一般
4、实验题 (8分)翰林汇现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制取少量CuCl2 ,其实验流程示意图如下:
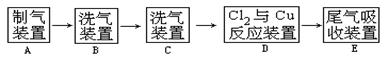
上图中“→”表示气流方向。请完成下列填空。
(1)A 中发生反应的离子方程式为????????????????????????????????;
(2)B中选用的试剂是???????????????????;
(3)D装置中的现象为???????????????????????;
(4)若E中的试剂选择KOH溶液,写出相应的吸收反应的化学方程式?????????????????????。
参考答案:(1)MnO2+4H++2Cl- 本题解析:
本题解析:
试题分析:(1)实验室制氯气的离子反应方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)B装置是除去Cl2中的HCl,所以用饱和食盐水。
(3)铜与氯气反应的现象是铜丝剧烈燃烧,产生棕黄色烟。
(4)用氢氧化钾吸收氯气的化学方程式为:Cl2+2KOH=KCl+KClO+H2O。
点评:本题主要考查的是实验室制氯气的实验,非常基础简单。
本题难度:一般
5、实验题 B. [实验化学]
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
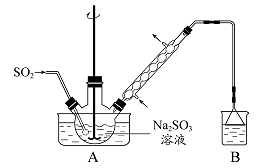
(1)装置B 的烧杯中应加入的溶液是?????????????????????。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是????????????????????????????
????。②冷凝管中回流的主要物质除H2O 外还有?????????????????????(填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有????????????、????????????(填仪器名称)。②滤渣的主要成分有???????????????、?????????????(填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是?????????????????????。
参考答案:
 本题解析:(1)装置B用来吸收剩余的SO2尾气,应该用NaOH溶液吸收。(2)①防止Zn(OH)2附着在锌粉的表面可用快速搅拌的方法。②反应物中的甲醛沸点较低,具有挥发性,会在冷凝管中冷却。(3)抽滤装置还包含布氏漏斗和吸滤瓶。滤渣中含有生成的Zn(OH)2以及部分未反应的锌。(4)由题意知,次硫酸氢钠甲醛具有强还原性,真空蒸发的目的是防止其被空气中的氧气氧化。
本题解析:(1)装置B用来吸收剩余的SO2尾气,应该用NaOH溶液吸收。(2)①防止Zn(OH)2附着在锌粉的表面可用快速搅拌的方法。②反应物中的甲醛沸点较低,具有挥发性,会在冷凝管中冷却。(3)抽滤装置还包含布氏漏斗和吸滤瓶。滤渣中含有生成的Zn(OH)2以及部分未反应的锌。(4)由题意知,次硫酸氢钠甲醛具有强还原性,真空蒸发的目的是防止其被空气中的氧气氧化。
【考点定位】化学实验模块
本题难度:一般