微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)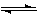 CH3OH(g)??ΔH=-a kJ·mol-1
CH3OH(g)??ΔH=-a kJ·mol-1
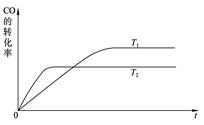
(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
①a __0(填“>” “<” “=”)。
②下列说法正确的是_?????????_(填序号)。
a.1mol CO(g)和2mol H2(g)所具有的能量小于1mol CH3OH(g)所具有的能量
b.将1mol CO(g)和2mol H2(g)置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g)?和H2(g)置于某密闭容器中充分反应后放热aKJ,则此过程中有1molCO(g)被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示:
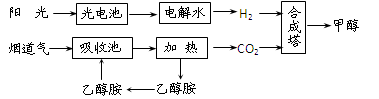
①该合成路线对于环境保护的价值在于_??????????????????????????????????_。
②15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
????????????????????????????????????????????????????????????????????????????。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_?????????????????????????????????????????????????????????????????_。

(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_????????????????????????????????????????????????????????????????????????????。
参考答案:(1)① >(2分)?②d(2分)
(2)①有利
本题解析:考查外界条件对平衡的影响以及电化学的应用等。
(1)根据图像可知,温度为T2的曲线先达到平衡状态,所以T2大于T1。随着温度的升高,反应物的转化率是降低的,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,a大于0;反应放热,说明反应物的总能量大于生成物的总能量,a不正确。反应是可逆反应,1mol CO(g)和2mol H2(g)不可能生成1mol甲醇,所以放出的热量要小于akJ,b不正确。反应热与物质前面的化学计量数有关,与平衡的移动方向无关,c不正确。所以选项d是正确的。
(2)根据
本题难度:一般
2、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:
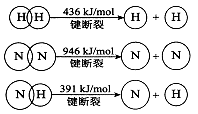
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
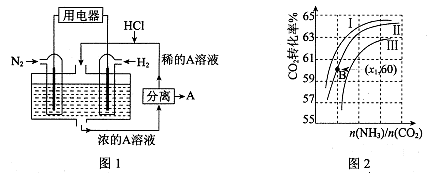
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比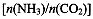 、水碳比
、水碳比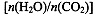 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
参考答案:(13分)
(1) 本题解析:
本题解析:
试题分析:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是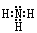
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
考点:考查电子式、热化学方程式、电极反应式的书写,平衡移动的判断,化学平衡常数的判断,对图像的分析能力
本题难度:困难
3、选择题 下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH =-1367.0 kJ·mol-1(燃烧热)
2CO2(g)+3H2O(g) ΔH =-1367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g) SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
D.2NO2 O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
参考答案::C
本题解析:
试题分析: A项燃烧热要求可燃物的物质的量必须为1 mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,A项错误;中和反应是放热反应,ΔH应小于0,B项错误;热化学反应方程式要注明物质在反应时的状态,D项错误;C项正确。
考点:燃烧热 能源
本题难度:一般
4、选择题 下列物质中,既有离子键,又有共价键的是
A.H2O
B.He
C.MgCl2
D.Na2O2
参考答案:D
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知A~D中含有的化学键分别是极性键、不含化学键、离子键、离子键和非极性键。答案选D。
本题难度:简单
5、简答题 (15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
A.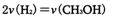
B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
 (3)已知在常温常压下:
(3)已知在常温常压下:

(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.

电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 。
参考答案:(15分)
(1)极性(2分)
(2)60%(2
本题解析:
试题分析:(1) 甲醇分子的正负电荷重心不重合,所以甲醇是极性分子;
(2)①:设消耗CO的物质的量为xmol,则CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
开始时(mol) 1 2 0
消耗(mol) x 2x x
平衡时(mol)1-x 2-2x x
根据题意可得1-x+2-2x+x=3/5(1+2)
解得x=0.6
所以CO的转化率为0.6mol/1mol×100%=60%
②A、未指明正逆反应且比例关系不符合化学计量数之比,错误;B、CO的消耗速率等于CH3OH的生成速率,均是正反应速率,未达平衡也符合,错误;C、恒容条件下,该反应的气体压强开始时一直减小,达平衡时不再变化,正确;D、恒容条件下,气体的总质量不变,所以气体的密度始终不变,错误;E、该反应中的气体均无色,错误;F、气体的总质量不变,物质的量在减小,混合气体的平均相对分子质量在减小,达平衡时,混合气体的平均相对分子质量不再变化,正确,答案选CF。
(3)根据盖斯定律,目标方程式=1/2(①-②)+2×③,所以△H=1/2(b-a)-2c=(b-a-4c)/2;
(4)①燃料电池的负极是燃料发生氧化反应,结合电解质溶液,所以负极的电极反应式为
CH3OH-6e-+8OH-=CO32-+6H2O
②溶液中各离子的物质的量分别为:n(Cu2+)=0.1mol,n(Cl-)=0.4mol,电解开始时,阳极是氯离子放电生成氯气2Cl---2e-=Cl2↑,阴极是Cu2++2e-==Cu,当0.1molCu2+放电完毕后H+放电2H++2e-==H2↑,此时阳极生成0.1mol氯气;随后阴极和阳极产生的氢气和氯气的物质的量相等,只有氯离子放电完毕后,才有可能两极产生的气体体积相等。当氯离子放电完毕,OH-开始放电时两极产生的气体的物质的量分别是阳极:Cl2 0.2mol,阴极:H2 0.1mol;设当生成O2xmol时两极产生的气体相等,则阴极又产生H22xmol,所以0.2+x=0.1+2x,解得x=0.1mol,所以氧气得质量为3.2g;
考点:考查分子极性的判断,化学平衡的计算,盖斯定律的应用, 电化学原理的应用
本题难度:困难