微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 取一定量可能含有Cu(NO3)2、AgNO3、KNO3三种物质中的一种或多种成分的粉末,加热后得到A气体aL,将气体用足量的水吸收,剩余气体B的体积为 L.下列相关推测正确的是
L.下列相关推测正确的是
A.NO2与O2的体积比为5:1
B.气体B可能是NO2
C.NO2与O2的体积比为2:1
D.固体粉末的组成为n[Cu(NO3)2]:n(AgNO3):n(KNO3)=1:3:1
参考答案:CD
本题解析:分析:KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:①2KNO3? 2KNO2+O2↑;
2KNO2+O2↑;
②2Cu(NO3)2 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
③2AgNO3 2Ag+2NO2↑+O2↑;
2Ag+2NO2↑+O2↑;
NO2与O2在水中反应的化学方程式如下:④4NO2+O2+2H2O═4HNO3,剩余气体可能为NO或O2,根据方程式讨论计算.
解答:KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:①2KNO3? 2KNO2+O2↑;
2KNO2+O2↑;
②2Cu(NO3)2 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
③2AgNO3 2Ag+2NO2↑+O2↑;
2Ag+2NO2↑+O2↑;
NO2与O2在水中反应的化学方程式如下:④4NO2+O2+2H2O═4HNO3,剩余气体可能为NO或O2,
如剩余气体为O2,设反应的O2为xL,
4NO2+O2+2H2O═4HNO3
4?? ?1
4x?? x
则4x+x=a- =
=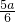 ,
,
x= ,
,
NO2与O2的体积比为 :
: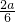 =2:1,
=2:1,
由反应的方程式可知,应满足:n[Cu(NO3)2]:n(KNO3)=1:1,n(AgNO3)可任意组成;
如剩余气体为NO,设反应的O2为yL,
3NO2+H2O═2HNO3+NO
 L???????????
L???????????  L
L
?4NO2+O2+2H2O═4HNO3
?4????1
?4y?? y
5y=
y=0.1a,
则NO2与O2的体积比为(0.4a+ ):0.1a=9:1,
):0.1a=9:1,
但是根据这些固体加热产生的NO2和O2的比例来看,生成的NO2与O2物质的量之比为9:1是不可能的,
因此:剩余气体只能为O2,且NO2与O2的体积比为2:1,混合物应应满足:n[Cu(NO3)2]:n(KNO3)=1:1,n(AgNO3)可任意组成,
故选CD.
点评:本题考查混合物的计算,题目难度较大,解答时注意反应的化学方程式,判断分解产物的气体之间的体积关系,为解答该题的关键点,也是易错点.
本题难度:简单
2、选择题 下列各组物质中,物质之间通过一步反应就能实现如图所示转化关系的是
A.①④
B.①②③
C.①③④
D.②④
参考答案:A
本题解析:分析:根据各组物质的化学性质及变化规律,分析各组物质间能按转化关系图完全物质间转化的一组;a→b→d→a;c→a? c→b;通过列出具体的反应,可以使分析和判断变得直观、简单.
解答:依据转化关系为:a→b→d→a;c→a c→b;对选项分析判断
①FeCl2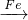 FeCl3
FeCl3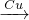 CuCl2
CuCl2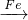 FeCl2;Fe
FeCl2;Fe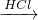 FeCl2、Fe
FeCl2、Fe FeCl3,故①符合;
FeCl3,故①符合;
②NO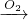 NO2
NO2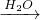 HNO3
HNO3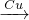 NO;N2
NO;N2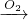 NO,N2不能一步转化NO2,故②不符合;
NO,N2不能一步转化NO2,故②不符合;
③Na2O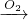 Na2O2
Na2O2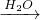 NaOH,NaOH不能一步转化为Na2O,故③不符合;
NaOH,NaOH不能一步转化为Na2O,故③不符合;
④Al2O3  NaAlO2
NaAlO2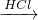 Al(OH)3
Al(OH)3 Al2O3 ,Al
Al2O3 ,Al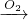 Al2O3 ,Al
Al2O3 ,Al NaAlO2,故④符合;
NaAlO2,故④符合;
综上所述:正确的是①④,
故选A.
点评:本题难度较大,根据常见化学物质的性质,通过列举具体反应,判断物质间是否可以实现一步反应的转化,采用排除法(即发现一步转化不能实现,排除该选项)是解答本题的捷径.
本题难度:困难
3、选择题 下列反应的离子方程式正确的是
A.Fe203溶于过量的氢碘酸中:Fe203+6H+=2Fe3++3H2O
B.向?NaAl02溶液中通入过量CO2:AlO2-+C02+2H2O=Al(OH)3↓+HCO3-
C.向漂白粉溶液中通入S02气体:Ca2++2ClO-+S02+H2O=CaSO3↓+2HCl0
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H20
参考答案:BD
本题解析:分析:A、氢碘酸具有还原性可以被三价铁氧化为碘单质;
B、偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠;
C、次氯酸具有强氧化性氧化亚硫酸钙为硫酸钙;
D、硝酸亚铁具有还原性在酸性溶液中被稀硝酸氧化为铁离子.
解答:A、氢碘酸具有还原性可以被三价铁氧化为碘单质,反应的离子方程式为Fe203++2I-+6H+=2Fe2++3H2O+I2,故A错误;
B、偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,AlO2-+C02+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、次氯酸具有强氧化性氧化亚硫酸钙为硫酸钙,Ca2++2ClO-+S02+H2O=CaSO4↓+2Cl-+2H+,故C错误;
D、硝酸亚铁具有还原性在酸性溶液中被稀硝酸氧化为铁离子,3Fe2++4H++NO3-=3Fe3++NO↑+2H20,故D正确;
故选BD.
点评:本题考查了离子方程式的书写方法和注意问题,掌握物质性质是解题关键,题目难度中等.
本题难度:简单
4、选择题 下列做法中,合理的是
A.洗涤蔬菜时,放入水中浸泡几分钟
B.长时间进行喷洒农药作物
C.不戴口罩使用有机磷农药
D.使用刚喷洒过农药的瓜果
参考答案:A
本题解析:分析:农药进入人体产生中毒的途径有3种,即经口,通过消化道进入;经皮,通过皮肤吸收;吸入,通过呼吸道进入.因此,防止农药中毒事故的主要措施都应针对这三种中毒途径,要尽可能防止农药从口、鼻、皮肤进入人体,而其中重点应防止皮肤污染;但不能禁用农药.
解答:A.洗涤蔬菜时,放入水中浸泡几分钟以去除残留农药,故A正确;
B.长时间进行喷洒农药作物会使残留农药增多,故B错误;
C.喷洒农药时注意个人防护,戴口罩使用有机磷农药,故C错误;
D.严禁采摘和使用刚喷洒过农药的瓜、果、蔬菜等,故D错误;
故选:A;
点评:本题考查农药的使用,难度不大,正确合理使用化学农药,是有效防治病虫害、提高作物品质和增加经济效益的关键.
本题难度:困难
5、选择题 某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
A.盐酸的物质的量浓度为3.0?mol?L-1
B.能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2?g?时盐酸未反应完
D.15.7?g?混合物恰好与盐酸完全反应
参考答案:D
本题解析:分析:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;生成3.36L二氧化碳需要混合物的质量为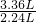 ×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
A、第二组实验中盐不足,混合物有剩余,第二组实验中发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为 =0.15mol,由方程式可知n(HCl)=n(CO2),据此计算.
=0.15mol,由方程式可知n(HCl)=n(CO2),据此计算.
B、第一组实验中混合物完全反应,盐酸过量,发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为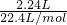 =0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知n(CO2)=n(NaHCO3)+n(KHCO3),再利用混合物质量列方程计算x、y的值,进而计算混合物中NaHCO3的质量分数.
=0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知n(CO2)=n(NaHCO3)+n(KHCO3),再利用混合物质量列方程计算x、y的值,进而计算混合物中NaHCO3的质量分数.
C、由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2?g时盐酸过量.
D、生成3.36L二氧化碳需要混合物的质量,与15.7g比较判断.
解答:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;生成3.36L二氧化碳需要混合物的质量为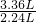 ×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
A、第二组实验中盐不足,混合物有剩余,第二组实验中发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为 =0.15mol,由方程式可知n(HCl)=n(CO2)=0.15mol,盐酸的物质的量浓度为
=0.15mol,由方程式可知n(HCl)=n(CO2)=0.15mol,盐酸的物质的量浓度为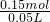 =3mol/L,故A正确;
=3mol/L,故A正确;
B、第一组实验中混合物完全反应,盐酸过量,发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为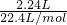 =0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知:x+y=0.1mol,混合物质量为9.2g,所以84x+100y=9.2g,联立方程解得x=0.05 mol,y=0.05 mol,能计算NaHCO3的质量分数,故B正确;
=0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知:x+y=0.1mol,混合物质量为9.2g,所以84x+100y=9.2g,联立方程解得x=0.05 mol,y=0.05 mol,能计算NaHCO3的质量分数,故B正确;
C、由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2?g时盐酸过量,故C正确;
D、生成3.36L二氧化碳需要混合物的质量为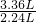 ×9.2g=13.8g<15.7克,所以混合物过量,盐酸不足,故D错误.
×9.2g=13.8g<15.7克,所以混合物过量,盐酸不足,故D错误.
故选:D.
点评:本题考查化合物的计算,题目难度较大,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点.
本题难度:困难