微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”;有一年很多地方的葡萄都减产甚至绝收,而法国小镇波尔多因为葡萄树都涂上了CuSO4与Ca(OH)2所以获得了大丰收。以下分析正确的是
A.CuSO4与Ca(OH)2含有葡萄生长所需的微量元素
B.CuSO4与Ca(OH)2混合物是化学肥料
C.Cu2+和碱可以使蛋白质变性,能杀死病菌,可以防治病虫害
D.CuSO4与Ca(OH)2混合物是有机农药,可以防治病虫害
参考答案:C
本题解析:强碱、重金属均可使蛋白质变性,能杀死病菌,可以防治病虫害,答案为C
本题难度:一般
2、填空题 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加_______,该过程的现象为:__________________________________________。
(2)步骤②加入过量H2O2的目的是:____________________________________。
(3)步骤③中反应的离子方程式是:_____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______、灼烧、_______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
参考答案:(1)氯水(或双氧水、稀硝酸等合理氧化剂)??溶液由浅绿色变
本题解析:(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸等),若滤液由浅绿色变为红色,则说明滤液中含有Fe2+。
(2)由于H2O2具有氧化性,加入过量H2O2的目的是:将Fe2+全部氧化为Fe3+。
(3)步骤③的目的是:将Fe3+全部转化为Fe(OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-=Fe(OH)3↓[或Fe3++ 3NH3·H2O=Fe(OH)3↓+ 本题难度:一般
本题难度:一般
3、选择题 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( ? )
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
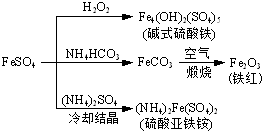
参考答案:D
本题解析:
本题难度:简单
4、选择题 0.7g铁粉放入40mL?1mol/L的稀硝酸中,反应停止后溶液中的盐是( )
A.只有Fe(NO3)3
B.只有Fe(NO3)2
C.Fe(NO3)3和Fe(NO3)2
D.不能确定
参考答案:0.7g金属铁的物质的量为:
本题解析:
本题难度:简单
5、填空题 (1)以铁为研究对象,仿照下图中的实例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物).
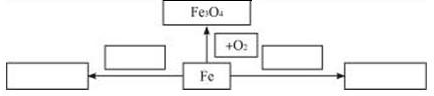
______
(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去.(只用简单的原理描述即可)?______
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一.联系生活生产实际,举出防止钢铁生锈的两种常用方法:
①______.?
②______.?
参考答案:(1)铁可以与盐酸或稀硫酸反应生成亚铁盐,可以与位于其后金属
本题解析:
本题难度:一般