微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.0.5mol SO2和11.2LCO2所含的分子数目一定相等
B.25℃和100℃时,水的pH相等
C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等
D.2SO2(g)+O2(g) 2SO3(g) 和4SO2(g)+2O2(g)
2SO3(g) 和4SO2(g)+2O2(g)  4SO3(g)的△H相等
4SO3(g)的△H相等
参考答案:C
本题解析:
试题分析:A、未标明状态,故无法确定;B、沸水pH在6左右,冰水的大于7,25℃等于7;C、正确。D选项,后者为前者的二倍。
本题难度:一般
2、选择题 若ag CO2含b个分子,则阿伏加德罗常数的值为 ( )
A.ab/28
B.ab/14
C.28/b
D.44b/a
参考答案:D
本题解析:考查物质的量的有关计算。ag CO2的物质的量是a/44mol,所以根据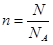 可知,阿伏加德罗常数的值为 44b/a,答案选D。
可知,阿伏加德罗常数的值为 44b/a,答案选D。
本题难度:一般
3、选择题 设NA表示阿伏加德罗常数的值,下列叙述中正确的是(???)
A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.在1mol Na2O2中阴离子数为2NA
C.标准状况下,3.36L丁烷中含有的碳碳键数为0.6NA
D.在1mol二氧化硅中硅氧键数为4NA
参考答案:AD
本题解析:略
本题难度:简单
4、实验题 某同学按下列步骤配制500mL 0.2mol·L-1 Na2SO4溶液,填空并回答有关问题。
实验步骤
| 有关问题
|
①计算所需Na2SO4的质量
| 需要称量Na2SO4的质量为 克
|
②称量Na2SO4固体
|
|
③将Na2SO4加入100mL烧杯中,并加入适量水溶解
|
|
④将烧杯中溶液转移至500mL容量瓶中
| 为了防止溶液溅出,应采取什么措施:
|
⑤向容量瓶中加蒸馏水至刻度线
| 在进行此操作时当加水至刻度线1—2厘米处应如何操作:
|
⑥摇匀
|
(1)上述实验步骤中缺一会严重影响溶液浓度的重要步骤,请简述此操作步骤:
若不完善此步骤,所得溶液浓度 (填偏高、偏低、无影响)
(2)配制Na2SO4溶液时,下列操作情况会使结果偏高的是 。
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀后,液面低于刻度线,再加水定容
参考答案:14.2, 转移过程中用玻棒进行引流,
本题解析:
试题分析:500mL 0.2mol·L-1 Na2SO4溶液中溶质的物质的量是0.1mol,质量是142g/mol×0.1mol=14.2g。转移液体时,为了防止溶液溅出应该用玻璃棒引流。定容时应该用胶头滴管。即改用胶头滴管加水至凹液面与刻度线相切。
(1)由于转移后烧杯中还有残留的溶质的,所以根据步骤可知,缺少洗涤,正确的操作应该是用蒸馏水洗涤用过的烧杯和玻璃棒二至三次,并将洗涤液转移至容量瓶中。如果没有洗涤,则溶质的质量减少,浓度偏低。
(2)根据c=n/V可知,如果移液前,容量瓶中有少量蒸馏水,则不会影响n和V,所以浓度不变;溶解搅拌时有液体飞溅,则溶质的质量减少,浓度偏低;定容时俯视容量瓶瓶颈刻度线,则V偏低,则浓度偏高;定容后,倒置容量瓶摇匀后,液面低于刻度线,再加水定容,则溶液体积偏大,浓度偏低,答案选C。
考点:考查一定物质的量浓度溶液的配置及有关误差分析等
点评:配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。在高考命题时,有关误差分析的内容既可以以选择题的形式进行考查,也可以以填空题的形式进行考查,既可以考查判断误差导致的结果,也可以考查引起误差的可能原因。
本题难度:一般
5、选择题 下列所得溶液的物质的量浓度等于0.1 mol·L-1的是
[???? ]
A.将0.1 mol HCl充分溶解在1 L水中
B.将60 g质量分数为10%的醋酸与940 g水混合
C.将3.1 g氧化钠溶于水并配成1 L溶液
D.将14.2 g Na2SO4·10H2O溶于水中配成1 L溶液
参考答案:C
本题解析:
本题难度:简单
|