微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 。稀释后还需要加入一些铁粉,其目的是 ,相关反应的离子方程式为 。
(2)氯化铁水溶液呈 性,原因是(用离子方程式表示):___________ ____ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
参考答案:(12分)(1)抑(防)止Fe2+水解(2分);
本题解析:(1)Fe2+离子会发生水解,离子方程式为: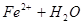 ?
?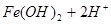 ,用浓盐酸溶解是为了抑(防)止Fe2+水解;又由于Fe2+离子易被氧气氧化生成
,用浓盐酸溶解是为了抑(防)止Fe2+水解;又由于Fe2+离子易被氧气氧化生成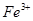 ,所以加入铁粉是为了防止Fe2+被氧化成Fe3+:
,所以加入铁粉是为了防止Fe2+被氧化成Fe3+: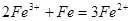 ;
;
(2)氯化铁水溶液呈酸性,原因是:Fe3+ + 3H2O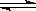 Fe(OH)3 + 3H+;把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是:Fe2O3;要从氯化铁溶液得到纯氯化铁固体,应将三氯化铁溶液在HCl环境(或气氛)中加热蒸干;
Fe(OH)3 + 3H+;把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是:Fe2O3;要从氯化铁溶液得到纯氯化铁固体,应将三氯化铁溶液在HCl环境(或气氛)中加热蒸干;
本题难度:简单
2、选择题 下列卤代烃能发生消去反应且消去产物唯一的是( )
A.CH3Br
B.(CH3)3CCH2Br
C.(CH3)3CBr
D.CH3CH2CHBrCH3
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.常温下电离常数为Ka的酸HA 溶液中 c (H+)=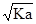 mol·L-1
mol·L-1
B.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
D.常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
参考答案:B
本题解析:
试题分析:A、Ka=c(H+)×c(A-)/c(HA),HA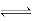 H++A-,c(H+)=
H++A-,c(H+)= 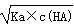 ,错误;B、反应后溶液中溶质:CH3COOH、CH3COONa,且两种物质的物质的量是相同,根据物料守恒得出:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两者合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确;C、有白色沉淀产生,只能说明此时溶液中的c(Ca2+)×c(SO42-)>Ksp(CaSO4),不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),错误;D、NH4HSO4和NaOH按1:1反应生成(NH4)2SO4、Na2SO4,溶液显酸性,按1:2反应Na2SO4、NH4·H2O,溶液显碱性,因此溶液显中性,若NH4HSO4是1mol,则NaOH的量应在1~2之间,NH4+水解,c(SO42-)>c(NH4+),因此浓度大小:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-),错误。
,错误;B、反应后溶液中溶质:CH3COOH、CH3COONa,且两种物质的物质的量是相同,根据物料守恒得出:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),两者合并得到:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确;C、有白色沉淀产生,只能说明此时溶液中的c(Ca2+)×c(SO42-)>Ksp(CaSO4),不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),错误;D、NH4HSO4和NaOH按1:1反应生成(NH4)2SO4、Na2SO4,溶液显酸性,按1:2反应Na2SO4、NH4·H2O,溶液显碱性,因此溶液显中性,若NH4HSO4是1mol,则NaOH的量应在1~2之间,NH4+水解,c(SO42-)>c(NH4+),因此浓度大小:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-),错误。
考点:考查弱电解质的电离、离子浓度大小的比较、溶度积的计算等知识。
本题难度:困难
4、选择题 蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
A.FeCl3
B.FeCl3·6H2O
C.Fe(OH)3
D.Fe2O3
参考答案:D
本题解析:FeCl3在水中发生水解:FeCl3+3H2O Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
本题难度:一般
5、选择题 下列粒子的个数比不是1∶1的是
A.NaHCO3晶体中的阴离子和阳离子
B.Na2O2固体中的阴离子和阳离子
C.氘原子中的质子和中子
D.NH3中的质子和的电子
参考答案:B
本题解析:
本题难度:简单