本题解析:由题意可写出NH4NO3受热分解的化学反应方程式:5NH4NO3 2HNO3+4N2↑+9H2O,A为HNO3,B为H2O。因为G为无色气体,能使湿润的红色石蕊试纸变蓝,则G为NH3。E与水反应生成NH3和不溶于水可溶于酸的白色固体F,E应为Mg3N2,F为Mg(OH)2,D为Mg。根据题目条件进行验证,分析推测
2HNO3+4N2↑+9H2O,A为HNO3,B为H2O。因为G为无色气体,能使湿润的红色石蕊试纸变蓝,则G为NH3。E与水反应生成NH3和不溶于水可溶于酸的白色固体F,E应为Mg3N2,F为Mg(OH)2,D为Mg。根据题目条件进行验证,分析推测
本题难度:简单
2、计算题 硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图像处理行业。?
(1)某金属M的硝酸盐受热时按下式分解:2MNO3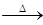 ?2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
?2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
(2)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L。其中NO的体积为_____________。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为???????。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为_____________。
参考答案:(1)108???(2)5.82L??(3)0.025mol
本题解析:(1)标准状况下,672ml气体的物质的量是0.672L÷22.4L/mol=0.03mol。因此根据反应的方程式可知,氧气的物质的量是0.01mol,所以硝酸盐的物质的量是0.02mol,则硝酸盐的相对分子质量是3.40÷0.02=170,所以M的相对原子质量是170-62=108。
(2)32.64g铜的物质的量是0.51mol,失去1.02mol电子。气体的物质的量是0.5mol,若设NO和NO2的物质的量分别是x和y,则x+y=0.5、3x+y=1.02,解得x=0.26mol,所以NO的体
本题难度:一般
3、选择题 下列反应中,属于氮的固定的是(???)
A.空气在雷电的作用下产生NO
B.NH3经催化氧化生成NO
C.NO2和H2O反应生成HNO3
D.由NH3制碳酸铵或硫酸铵
参考答案:A
本题解析:
试题分析:将空气中游离态的氮转化为含氮化合物的过程叫氮的固定。因此,B、C、D都是错误的。故选A。
点评:本题考查的是氮的固定。氮的固定是指将空气中游离态的氮转化为含氮化合物的过程,只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:简单
4、实验题 某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)
 ?
?
(1)E装置中制取NO2反应的离子方程式是????????????。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取???????。
a.NH4HCO3??? b.NH4Cl??? c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是???????????????????????。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③???????????????????????????。
(5)此实验装置存在一个明显的缺陷是????????????????????????????。
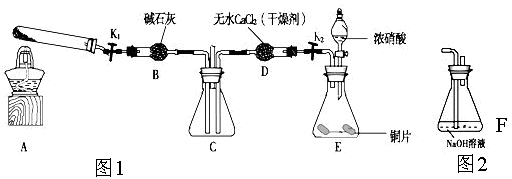
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
参考答案:(14分)(1)Cu+4H++2NO3-=Cu2++2NO2
本题解析:
试题分析:(1)浓硝酸具有强氧化性,能和铜反应生成硝酸铜、二氧化氮和水,反应的离子方程为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。
(2)a、加热NH4HCO3时,碳酸氢铵分解生成氨气、水和二氧化碳,除去水和二氧化碳就可以得到氨气,故a正确;b、加热NH4Cl时,氯化铵分解生成氨气和氯化氢,但温度降低后,氨气和氯化氢又反应生成氯化铵,所以得不到氨气,故b不正确;c、浓氨水是液体,试管中的药品是固体,所以不符合要求,故c不正确,答案选a。
(3)二氧化氮是红棕色气体,如果
本题难度:困难
5、选择题 在标准状况下,将O2和NO2按1:4体积比充满一干燥的烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升。最后烧瓶内溶液的物质的量浓度是
A.0.045mol/L
B.0.036mol/L
C.0.026mol/L
D.0.028mol/L
参考答案:B
本题解析:O2+4NO2+2H2O=4HNO3,由该方程可以看出1体积的氧气与4体积的二氧化氮恰好可以完全与水反应,换句话说将烧瓶倒置于水中后,水将充满整个烧瓶,整个溶液的体积就是烧瓶的体积,假设烧瓶体积为1L,那么原来烧瓶中的气体就有1L,NO2气体物质的量为1L÷5×4÷22.4L·mol-1=0.036mol,根据氮元素守恒,可推断HNO3物质的量为0.036mol,所以物质的量浓度为0.036mol÷1L=0.036mol/L,答案选B.
本题难度:一般