微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了保护地下钢管不受腐蚀,可使它与( )
A.直流电源正极相连
B.铜板相连
C.锌板相连
D.直流电源负极相连
参考答案:A.钢管与直流电源的正极相连,则钢管作电解池阳极,电解池工作
本题解析:
本题难度:一般
2、选择题 用石墨作电极电解1 L 1 mol·L-1 CuSO4溶液,当c(Cu2+)="0.5" mol·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况(???)
A.CuSO4
B.CuO
C.Cu(OH)2
D.CuSO4·5H2O
参考答案:B
本题解析:电解过程中的反应为:阳极:4OH--4e-====2H2O+O2↑,阴极:Cu2++2e-====Cu,总反应为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,由以上反应可知,电解使2 mol CuSO4和2 mol H2O变成了2 mol H2SO4,同时析出Cu,放出O2,溶液中每生成1 mol H2S
2Cu+2H2SO4+O2↑,由以上反应可知,电解使2 mol CuSO4和2 mol H2O变成了2 mol H2SO4,同时析出Cu,放出O2,溶液中每生成1 mol H2S
本题难度:一般
3、选择题 下列防止金属腐蚀的做法不可行的是
A.在某些工具的机械转动部位刷油漆以防锈
B.衣架和电线外面包上一层塑料层以防锈
C.在钢材制造的大型船舶上装上一定数量的锌块。
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
参考答案:A
本题解析:
试题分析:在某些工具的机械转动部位刷油漆以防锈并不能防止金属的腐蚀,因为机械转动部位容易磨损油漆,导致金属的腐蚀,其余选项都是可以防止腐蚀的,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重考查学生灵活运用电化学原理解决实际问题的能力。该题的关键是明确原电池和电解池的工作原理,然后灵活运用即可。
本题难度:简单
4、选择题 下列各种方法中:①金属表面涂抹油漆;②改变金属内部结构;③保持金属表面清洁干燥;④在金属表面进行电镀;⑤使金属表面形成致密的氧化物薄膜,其中能对金属起到防护或减缓腐蚀作用的是( )
A.①②③④
B.①③④⑤
C.①②④⑤
D.全部
参考答案:C
本题解析:
本题难度:一般
5、填空题 如图所示三套实验装置,分别回答下列问题。
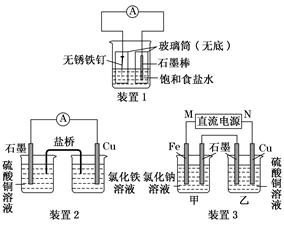
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀,表明铁被________(填“氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应式为________________________________________________________________________。
(2)装置2中的石墨是________极(填“正”或“负”),该装置发生的总反应的离子方程式为________________________________________________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为________极;甲烧杯中铁电极的电极反应式为_________________。
②乙烧杯中电解反应的离子方程式为_____________________________ ____。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体标准状况下的体积为________mL。
参考答案:(1)氧化 O2+4e-+2H2O=4OH- (2)正 2F
本题解析:(1)装置1,由石墨棒附近的溶液变红可知,石墨棒作正极,电极反应式为O2+4e-+2H2O=4OH-,铁钉作负极,发生氧化反应。
(2)由装置2两电极活泼性强弱得Cu一定是负极,总反应的离子方程式即该装置中自发的氧化还原反应:2Fe3++Cu=2Fe2++Cu2+。
(3)①由甲中石墨电极附近首先变红可知该极H+放电,即该极为阴极,Fe为阳极,电极反应式为Fe-2e-=Fe2+,由此可知,电源M端为正极;
②电源M端为正极,N端为负极,乙中Cu为阴极,石墨为阳极,发生反应的离子方程式为2
本题难度:一般