微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作正确的是[???? ]
A.蒸发操作时,应使混合物中的水分完全蒸干才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶底部
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,所选择的萃取剂的密度必须比水大
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列实验中,没有颜色变化的是
A.淀粉溶液中加入稀硫酸
B.鸡蛋清中加入浓硝酸
C.淀粉溶液中加入碘酒
D.葡萄糖溶液与新制氢氧化铜浊液混合加热
参考答案:A
本题解析:
正确答案:A
A、无明显现象;B、显黄色;C、呈蓝色;D、有砖红色沉淀产生。
本题难度:一般
3、选择题 下列实验方案能达到目的是( )
A.除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B.实验室获取少量纯净的水:蒸馏自来水
C.SiO2中的CaO,通过加热熔融而除去
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
参考答案:B
本题解析:
本题难度:简单
4、填空题 锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
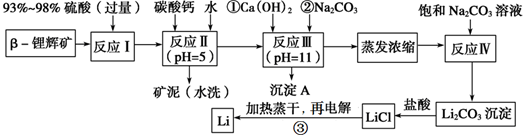
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物
| Fe(OH)3
| Al(OH)3
| Mg(OH)2
|
开始沉淀pH
| 2.7
| 3.7
| 9.6
|
完全沉淀pH
| 3.7
| 4.7
| 11
?
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式_________________________;
(2)反应Ⅱ加入碳酸钙的作用是_______________;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由? ____________;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:
(流程常用的表示方式为: ) )
参考答案:
(1)2FeO+4H2SO4(浓)
本题解析:
试题分析:
(1)浓硫酸有氧化性,FeO有还原性,二者在加热时会发生氧化还原反应。根据质量守恒定律和电子守恒可得该反应的方程式为:2FeO+4H2SO4(浓)  Fe2(SO4)3+SO2↑+4H2O。 Fe2(SO4)3+SO2↑+4H2O。
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的剩余的H2SO4;调节溶液的pH,同时使Fe3+、Al3+完全转化为沉淀而除去。
(3)在反应Ⅲ中只需加入碳酸钠溶液,因为其碱性是盐水解产生的,碱性不如NaOH强,而且MgCO3的溶解度比Mg(OH)2大,不能很好的把Mg2+沉淀出去。因此不能达成该步骤的目的。
(4)加热蒸发时,只要看到大量固体析出或者仅余少量液体时,停止加热,利用余热把固体蒸干。
(5)步骤③中电解时,阳极产生的氯气中会混有少量氧气,是因为在加热蒸干LiCl溶液时,LiCl有少量发生水解反应产生了LiOH混在LiCl中。LiOH受热分解生成Li2O,电解时产生了O2。
(6)水洗后的矿泥中含有Fe2O3、Al2O3、SiO2.可以先加盐酸把Fe2O3、Al2O3溶解变为FeCl3、AlCl3,除去难溶的SiO2.然后向溶液中加入过量的NaOH溶液,发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl。AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。把Fe(OH)3沉淀过滤除去,然后向滤液中通入过量的CO2气体,发生反应NaAlO2+ CO2+2H2O= Al(OH)3↓+NaHCO3.把Al(OH)3沉淀过滤出来洗涤干净,然后灼烧既得Al2O3。另一种方法是把矿泥用NaOH溶液处理,可以得到NaAlO2和Na2SiO3溶液,而Fe2O3不溶,过滤除去。然后向滤液中加入过量的盐酸发生反应NaAlO2+4HCl= AlCl3+NaCl+2H2O。Na2SiO3+2HCl=H2SiO3↓+2NaCl。把硅酸沉淀过滤除去,再向滤液中通入过量的氨气,发生反应AlCl3+3NH3+3H2O= Al(OH)3↓+3NH4Cl。再把Al(OH)3沉淀过滤出来洗涤干净,然后灼烧既得Al2O3。2O3的方法的知识。
本题难度:困难
5、选择题 一试剂瓶中装有甲和乙两种物质的混合物,已知甲和乙的某些性质如下表:
物质
| 化学式
| 熔点:℃
| 沸点:℃
| 密度:g·cm-3
| 溶解性
| 甲
| C3H6O2
| -98
| 47.5
| 0.93
| 溶于水和有机溶剂
| 乙
| C4H8O2
| -84
| 77
| 0.90
| 溶于水和有机溶剂
据此,将甲和乙互相分离的最佳方法是
A. 萃取????????B. 过滤???????C. 蒸馏?????????? D. 洗气
参考答案:C
本题解析:从表中可以看出二者的沸点差异较大,故可以使用蒸馏的方法分离。
本题难度:一般
|
|