微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 现有四瓶未知溶液它们是:NaCl(0.1mol/L)、NaOH(0.1mol/L)、HCl(0.1mol/L)、酚酞(0.1mol/L),某化学性质小组,为了将它们鉴别出来,而又没有其他任何试剂,于是同学们采取如下的实验步骤:
(1)将四瓶溶液用A、B、C、D标记
(2)取少许溶液两两混合,根据实验现象将四种物质分成两组
(3)取甲组混合液,不断滴入乙组中的一种未知液,可以鉴别出 A:??????????B:??????????
(4)再取已鉴别出的溶液2ml,滴入3滴C溶液,再滴加D溶液4ml,在整个过程中无明显的实验现象;可知C?????????D??????????(写化学式)写出上述实验过程中反应的离子方程式???????????????
参考答案:A :HCl、B:NaCl、C:酚酞、D :NaOH?? H
本题解析:四种溶液少许两两混合可产生两中不同的现象:NaOH溶液酚酞混合后溶液呈红色,NaCl和HCl混合溶液无色,向NaOH和酚酞的混合液中滴加HCl溶液,红色消失,而滴入NaOH时,无现象,从而可的出HCl和NaCl来。再取2ml0.1mol/l的盐酸,若先滴3滴0.1mol/lNaOH溶液,再滴加4ml酚酞则溶液变红色,因此检验出NaOH溶液和酚酞。
本题难度:简单
2、选择题 下列实验操作不正确的是[???? ]
A.吸滤完毕停止吸滤时,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关闭水龙头
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
参考答案:C
本题解析:
本题难度:简单
3、实验题 (15分)某校一研究性学习小组对胆矾晶体受热分解进行讨论。
Ⅰ.他们查阅资料得知:将胆矾晶体置于烘箱中加热时,在79~134℃,晶体失重14.4%;134~250℃,又失重14.4%;250~300℃,再失重7.2%。之后加热至620℃,质量维持不变。小组经过计算得出,胆矾在300~620℃的固体残留物为无水硫酸铜,134℃时的固体残留物的化学式为????????????????????。
Ⅱ.小组对无水硫酸铜继续升温加热的可能变化进行猜想。他们提出了产物的以下几种猜想:
①.CuO、SO3;。
②.CuO、SO2和O2;
③.CuO、SO3和SO2;
④.CuO、SO3、SO2和O2
小组经过激烈讨论,认为猜想③不用实验就可排除,他们的理由是???????????????????
查阅资料:①SO3为无色晶体,熔点16.6℃,沸点44.8℃。
②SO2,熔点:-72.4℃,沸点:-10℃;SO2通入BaCl2溶液中,无明显现象。
Ⅲ.实验探究:
小组按下图所示安装好实验装置。

(1)安装好装置后,未装药品前必须进行的操作是??????????????????????????。
D装置的作用是????????????????????。
(2)按图示装好药品后,用酒精喷灯对着硬质试管加热。一会儿后,B中溶液产生白色浑浊,C中溶液逐渐褪色。
Ⅳ.实验结果分析:
(1)小组同学大多认为无水硫酸铜热分解产物应该为猜想④。但有一个同学提出质疑,他认为B中溶液产生白色浑浊并不一定能确定产物中含有SO3。他的依据涉及的化学方程式是????????????????????????????????????????。于是,小组同学经讨论决定,再增加一个装置E,你认为该装置应加在??????????(填装置字母)之间。增加装置后,小组重新实验,证明了产物中确实存在SO3。你认为他们根据什么现象得到这一结论???????????????????????????????????????。
(2)小组在完成无水硫酸铜热分解的化学方程式时遇到了困难。他们发现该化学方程式为不定方程式,存在无数种配平情况,经过慎密地分析,他们认为只要能确定某些物质的计量数之比,即可确定该化学方程式。如已知SO2与SO3的计量数之比,就能确定该化学方程式。若设SO2与SO3的计量数之比为x,请写出配平后的化学方程式???????????????????。
参考答案:Ⅰ.CuSO4·3H2O
Ⅱ.产物中只有降价元素而无升
本题解析:
试题分析:Ⅰ.胆矾晶体在79~134℃,晶体失重14.4%,若是1mol晶体,则失去水为250g×14.4%=36g,即2molH2O。134℃时的固体残留物是CuSO4·3H2O。
Ⅱ.③是CuSO4·5H2O变为CuO、SO3和SO2,生成SO2时S的化合价降低,没有元素化合价升高,故假设不成立。
Ⅲ.(1)安装好装置后,未装药品前必须进行的操作是检验装置气密性。D装置中盛放NaOH溶液作用是吸收酸性尾气,防止污染环境。
本题难度:困难
4、选择题 有Mg、Al、Fe、Cu四种金属,若两两混合,取26 g混合物与足量稀H2SO4反应,产生11.2 LH2(标准状况).此混合物的可能组合的方式最多有
A.2种
B.3种
C.4种
D.5种
参考答案:C
本题解析:设金属反应后均为二价阳离子,则上述金属对应的摩尔质量分别为24 g·mol-1、18 g·mol-1、56 g·mol-1和无穷大(因铜与稀硫酸不反应),根据产生的氢气知两种金属的平均摩尔质量为52 g·mol-1,故对应的组合有Mg、Fe;Mg、Cu;Al、Fe;Al、Cu四种.
本题难度:简单
5、简答题 某实验小组用工业上废弃固体(主要成分为Cu2S和Fe2O3混合物)制取铜和FeCl3固体,设计的操作流程如下:
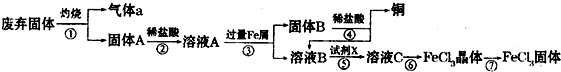
(1)除酒精灯和铁架台或三角架外,①中所需的容器为______,①和⑥中都用到的仪器为______.
(2)固体B加入稀盐酸后,④的操作是______.
(3)试剂x的化学式为______,X与溶液B反应的离子方程式为______.
(4)在实验室中,用36.5%(密度为1.19g?mL-1)的盐酸,配制1L 3mol?L-1的盐酸,则需量取36.5%的盐酸______mL.
(5)简述溶液C中所含金属阳离子的检验方法______.
(6)第⑦步操作中,所需装置如图所示:
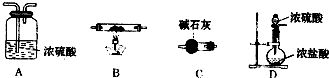
①按气流方向从左到右的顺序,各装置的连接顺序为______.
②C的作用是______.
参考答案:(1)①、灼烧固体应该放在坩埚中;①和⑥操作都用到玻璃棒,故
本题解析:
本题难度:一般