微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水、③苯和溴苯的混合液,分离它们的正确方法依次是
A.分液、蒸馏、分液
B.萃取、分液、蒸馏
C.分液、萃取、蒸馏
D.蒸馏、分液、萃取
参考答案:C
本题解析:
试题分析:乙酸乙酯和乙酸钠溶液不互溶,采用分液的方法分离;溴在四氯化碳中的溶解度大于在水中的溶解度,所以溴化钠溶液和溴水采用萃取的方法分离;苯和溴苯的混合液互溶,所以采用蒸馏的方法分离,答案选C。
本题难度:一般
2、选择题 只用水就能鉴别的一组物质是
A.苯,乙酸,四氯化碳
B.乙醇,甲苯,乙酸
C.乙醇,硝基苯,溴苯
D.己烷,乙醇,乙酸乙酯
参考答案:A
本题解析:苯不溶于水,在上层,乙酸和水互溶,四氯化碳不溶于水,在下层,A正确。B中乙醇、乙酸和水互溶,不能鉴别。C中硝基苯、溴苯均不溶于水,无法鉴别。D中己烷、乙酸乙酯均不溶于水,无法鉴别。所以答案选A。
本题难度:简单
3、选择题 下列有关实验操作、现象和解释或结论都正确的是
选项
| 实验操作
| 现象
| 解释或结论
|
A
| 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
| 出现白色沉淀
| 溶液X中一定含有SO42-
|
B
| 用铂丝蘸取溶液Y进行焰色反应
| 火焰呈黄色
| 溶液Y中含Na+,不含K+
|
C
| 向一定浓度的Na2SiO3溶液中通入适量CO2气体
| 出现白色沉淀
| H2SiO3的酸性比H2CO3的酸性强
|
D
| 向饱和Na2CO3溶液中通入足量CO2
| 溶液变浑浊
| 析出了NaHCO3
?
参考答案:D
本题解析:
试题分析:A、向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液出现白色沉淀,该沉淀一定是硫酸钡,但由于硝酸具有强氧化性,因此如果溶液中含有SO32-,也可以被氧化生成SO42-,所以A不正确;B、用铂丝蘸取溶液Y进行焰色反应,火焰呈黄色说明一定含有钠离子。但由于观察钾元素的焰色反应需要透过蓝色的钴玻璃,因此不能确定溶液中是否含有钾离子,B不正确;C、向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则根据较强酸制备较弱酸可知,H2SiO3的酸性比H2CO3的酸性弱,C不正确;D、由于碳酸氢钠的溶解度小于碳酸钠的溶解度,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠固体,D正确,答案选D。
本题难度:一般
4、选择题 下列分离方法正确的是
A.分离汽油和水可以用结晶的方法
B.出去氯化钠溶液中的泥沙用分液的方法
C.分离醋酸(沸点118℃)与乙酸乙酯(沸点77.1℃)用蒸馏的方法
D.从含有少量氯化钠的硝酸钾溶液中提取硝酸钾用过滤的方法
参考答案:C
本题解析:
试题分析:汽油与水互不相溶,采用分液的方法分离,A错误;除去氯化钠溶液中的泥沙应用过滤法,B错误;醋酸和乙酸乙酯互溶、沸点相差大,可用蒸馏的方法分离,C正确;混有少量氯化钠的硝酸钾应用结晶的方法分离,D错误。
点评:含有少量硝酸钾的氯化钠溶液除去硝酸钾的方法是蒸发浓缩、趁热过滤。
本题难度:一般
5、填空题 某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。
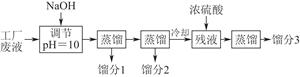
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
物质
| 丙酮
| 乙酸乙酯
| 乙醇
| 乙酸
| 沸点(℃)
| 56.2
| 77.06
| 78
| 117.9
?
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
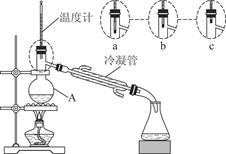
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。
(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010? mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。
(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗
参考答案:(1)乙酸
(2)使乙酸生成乙酸钠;使乙酸乙酯在加热蒸
本题解析:(1)~(2)该流程的原理为:首先加入NaOH溶液调节pH=10,使乙酸转化为难挥发的乙酸钠,同时,乙酸乙酯在加热蒸馏时也发生水解生成难挥发的乙酸钠和乙醇,这样在第一次蒸馏时可得丙酮和乙醇两种馏分;向残液中加入浓硫酸,发生反应2CH3COONa+H2SO4(浓)―→Na2SO4+2CH3COOH,再加热至118 ℃,收集馏出物,得乙酸。
(3)蒸馏装置温度计测量的是蒸出的蒸气的温度,故温度计的感温泡应置于蒸馏烧瓶支管口附近。
(4)①若为优质白酒,则其中醋酸的最小含量为0.30 g/L,其物质的量浓度为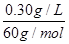 =0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。 =0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
②该实验的原理是加入过量的氢氧化钠溶液加热使之充分水解,再用稀硫酸滴定过量的氢氧化钠,通过乙酸乙酯消耗的氢氧化钠的量来求出乙酸乙酯的量。n(CH3COOCH2CH3)=20.00×10-3 L×0.100 mol·L-1-7.70×10-3 L×2×0.100 mol·L-1=0.000 46 mol,故该白酒样品中总酯量为 =2.024 g·L-1。 =2.024 g·L-1。
(5)加热时未使用冷凝管可导致乙酸乙酯蒸气逸出,使乙酸乙酯消耗氢氧化钠溶液体积偏小,造成结果偏小;滴定前滴定管内无气泡,滴定后产生气泡,滴定时消耗硫酸体积读数偏小,造成计算时乙酸乙酯消耗氢氧化钠溶液体积偏大,结果偏大;滴定管未用标准硫酸溶液润洗,滴定时消耗硫酸体积偏大,造成乙酸乙酯消耗氢氧化钠溶液体积偏小,结果偏小。
本题难度:一般
|
|