微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量)
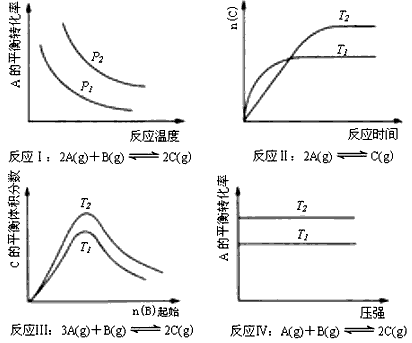
根据以上规律判断,上列结论正确的是[???? ]
A.反应Ⅰ:△H>0, P2>P1
B.反应Ⅱ:△H<0, T1<T2
C.反应Ⅲ:△H>0, T2>T1; 或△H<0, T2<T1
D.反应Ⅳ:△H<0, T2> T1
参考答案:BC
本题解析:
本题难度:一般
2、选择题 T℃时,在1L的密闭容器中充入2mol?CO2和6mol?H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-49.0kJ?mol-1测得H2和CH3OH(g)的浓度随时间变化如下图所示.下列说法不正确的是( )
| 时间 | c?(H2)/mol?L-1 | c?(CH3OH)/mol?L-1 | v(正)和v?(逆)
比较
?t0
6
0
?
t1
3
1
v(正)=v(逆)
A.t0~t1时间内υ(H2)=3
t1-t0
?mol?(L?min)-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T℃时,平衡常数K=1/27,CO2与H2的转化率相等
参考答案:A、t0~t1时间内υ(H2)=
本题解析:
本题难度:简单
3、选择题 在mA(气)+nB(气) pC(气)+qD(气)反应中,经10min达平衡,此时各物质的浓度变化为:A减少amol/L,B减少a/3?mol/L,C增加2a/3?mol/L,此时若给体系加压,化学平衡不移动,则m:n:p:q为???????????????????????????[???? ] pC(气)+qD(气)反应中,经10min达平衡,此时各物质的浓度变化为:A减少amol/L,B减少a/3?mol/L,C增加2a/3?mol/L,此时若给体系加压,化学平衡不移动,则m:n:p:q为???????????????????????????[???? ]
A.1:1:1:1????????????????????????
B.1:3:3:1
C.1:3:2:2????????????????????????
D.3:1:2:2
参考答案:D
本题解析:
本题难度:一般
4、选择题 一定条件下,可逆反应N2+3H2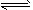 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是[???? ] 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是[???? ]
A.加催化剂,V正.V逆都发生变化,且变化的倍数相等
B.加压,V正.V逆都增大,且V正增大的倍数大于V逆增大的倍数
C.降温,V正.V逆都减小,且V正减小的倍数大于V逆减小的倍数
D.增大氮气的浓度,V正.V逆都增大,且V正增大倍数大于V逆增大倍数;N2转化率减小,H2转化率增大
参考答案:C
本题解析:
本题难度:一般
5、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:
2CO(g)+O2(g)=2CO2(g)??△H=-566kJ/mol?
2Fe(s)+3/2O2(g)=Fe2O3(s)?△H=-825.5?kJ/mol
反应:Fe2O3(s)+3CO(g)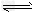 2Fe(s)+3CO2(g)??△H=_______kJ/mol。 2Fe(s)+3CO2(g)??△H=_______kJ/mol。
II.反应?1/3Fe2O3(s)+CO(g)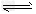 2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。 2/3?Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
(1)CO的平衡转化率=?_____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度????b.增大反应体系的压强 c.选取合适的催化剂???
d.及时吸收或移出部分CO2? e.粉碎矿石,使其与平衡混合气体充分接触
III.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
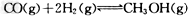 ??。请根据图示回答下列问题: ??。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率?(H2)=?________。
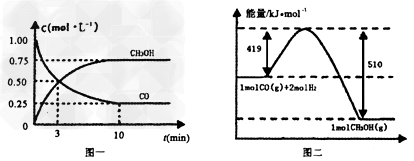
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表
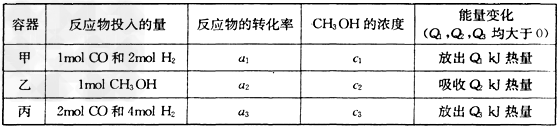
则下列关系正确的是________。
A.c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1?+a2?=1
E.该反应若生成1mol?CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l?molCO、2mol?H2和1mol?CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式__________________。
参考答案:I.-23.5?
II.(1)?60%;(2)d
本题解析:
本题难度:一般
|
|